|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > タンパク質サンプル調製・前処理 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
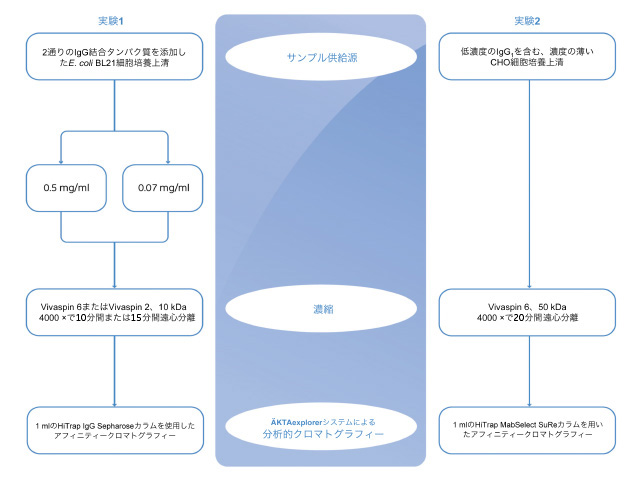
Vivaspin™を用いた細胞培養上清や大腸菌培地からのタンパク質の濃縮と回収F. Sabounchi Schütt
限外ろ過は希薄な溶液のタンパク質濃度を高める単純で効率的な手法です。Vivaspin™を使用し、サンプルを濃縮することで、IgGの検出や定量に十分な濃度に調整することができました。一方、Vivaspin™で濃縮しなかった場合には、サンプル中のIgG1は濃度が低すぎてアフィニティークロマトグラフィーで検出できませんでした。 はじめにクロマトグラフィーで回収したサンプルは、濃度が低すぎるために次の精製ステップに直接使用できないか、生物学的アッセイで検出できず、定量できないことがあります。 Vivaspin™は、限外ろ過によりバッファーおよび低分子量成分を効率的に除去すると同時に、タンパク質の濃度を高めます。最大30倍のサンプル濃度が得られ、一般に目的分子の回収率は95%を超えます。限外ろ過のプロセス全体は1本のチューブの中で行われます。このチューブは規定の分画分子量(MWCO)値を有する半透膜で上下のチャンバーに分離されており、まず上部のチャンバーにサンプルを入れます。チューブを遠心すると、溶媒が半透膜を通過し、上部のチャンバーにおけるサンプルの濃度が高まります。 本試験では、E. coli培地とほ乳動物細胞株培養上清の濃縮を、Vivaspin™を用いて行いました。 第1の実験では、2種類の代表的なモデルタンパク質をE. coli培地に添加しました。モデルタンパク質として、ひとつは細胞内発現タンパク質であるプロテインL、もうひとつは分泌型のペリプラズムタンパク質であるZätAを用いました。通常、細胞内発現タンパク質を得るには、超音波処理などの機械的処理で細胞内壁を破壊する必要があります。ペリプラズムタンパク質の場合、タンパク質を培地に直接分泌させるために熱処理がしばしば使用されます。いずれの場合にも、通常、不要なタンパク質が目的タンパク質ととも培地に入ります。これらのタンパク質の抽出、精製を最適化するには、培地中にどういったものが含まれているかを理解しておくことが重要です。 第2の実験では、希薄なCHO細胞培養上清からIgG1の濃縮と回収を行いました。CHO細胞培養上清からIgG1を精製するにはいくつかの精製ステップが必要で、その際サンプルの濃縮が必要となることがあります。サンプル中の不要な低分子成分の除去と目的タンパク質の濃縮がVivaspin™で行えることを確認するため、アフィニティークロマトグラフィーを行いました 方法機器はすべてメーカーのプロトコルに沿って使用しました。濃縮前の初期吸光度を測定した後に規定量のサンプルをVivaspin™にアプライしました。Vivaspin™で濃縮を行った後、濃縮後の溶液を回収して規定の体積まで希釈し、再度吸光度を測定しました。 表1 Vivaspin™を用いた濃縮実験の結果
* Conc. Factor = starting volume/recovered volume なお、すべてのクロマトグラフィーはUNICORN™ソフトウェアv5.01を搭載したÄKTA™explorerシステムを用いました。 細菌細胞培養液サンプルE. coli BL21を、滅菌2TY培地(16 g/lのペプトン、10 g/lの酵母エキス、5 g/lのNaClを含む、pH 7.0)を用いて37℃で一晩増殖させました。10℃で10分間の遠心分離により集菌した後、上清を回収して使用時まで低温保存しました。Vivaspin™による濃縮の前後の定量比較を十分に行えるように、培地上清に既知濃度のプロテインL(0.5 mg/ml)またはZätA(0.07 mg/ml)を添加しました。次にサンプルの濃縮はVivaspin™ 2およびVivaspin™ 6(MWCO 10 000)を使用して行いました。Vivaspin™による濃縮の前と後に、280 nmでプロテインLの吸光度を測定し、273 nmでZätAの吸光度を測定しました。 この時、タンパク質濃度は標準添加法を用いて測定しました。サンプルを5つに分けて、それぞれに既知濃度の標準タンパク質を異なる濃度で添加しました。この方法を使用することにより、タンパク質のマトリックス効果を低減しました。標準添加法には最低1.5 mlのサンプルが必要であったため、Vivaspin™から回収したサンプルは使用前に1500 μlに希釈しました。 プロテインLおよびZätAはIgG結合タンパク質のため、Vivaspin™による濃縮後のサンプルは、1 mlのHiTrap™ IgG Sepharose™を使用してアフィニティークロマトグラフィーを行いました。 ほ乳動物細胞培養液サンプル清澄化されたCHO細胞培養上清(Polymun Scientific, オーストリア)は、IgG1含量が0.2 μg/ml未満で、pH指示薬としてフェノールレッドが含まれています。この上清の濃縮をVivaspin™ 6(MWCO 50 000)で行いました。濃縮後の上清を一度4倍に希釈し、1 mlのHiTrap™ MabSelect SuRe™ででアフィニティークロマトグラフィーを行いました。、このステップによりIgG1濃度を測定できるように濃縮しました。
表2 アプリケーション試験に用いた実験条件
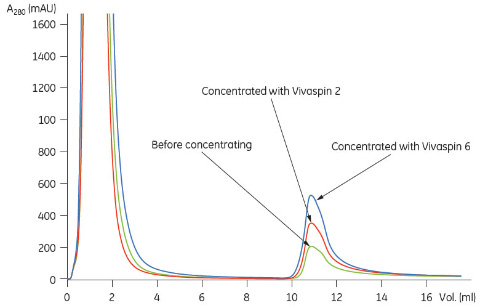
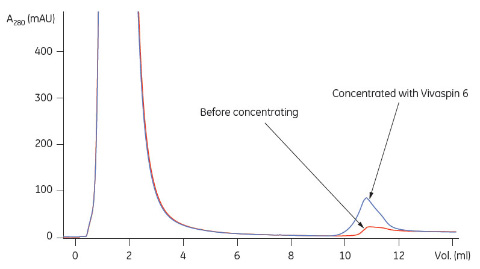
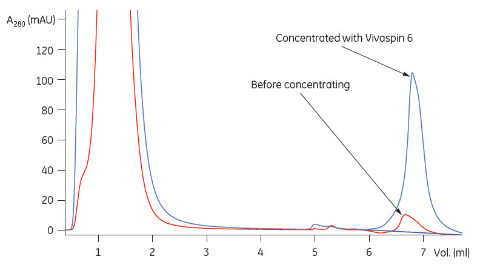
* 標準添加法によるタンパク質濃度測定。サンプルを5つに分け、それぞれに既知濃度の標準タンパク質を異なる濃度で添加しました。この方法を使用することにより、タンパク質のマトリックス効果を低減しました。標準添加法には最低1.5 mlのサンプルが必要であったため、Vivaspin™ 2から回収したサンプルは使用前に1500 μlに希釈しました。 結果表1に、Vivaspin™による濃縮前後でのプロテインL、ZätAおよびIgG1の標準添加法による定量の結果を示します。サンプルのボリュームに合ったVivaspin™を使用することで86%という高い回収率を得ることができました。なお、CHO細胞培養上清の場合、元の濃度が低く定量できなかったことから回収率を計算できませんでした。 Vivaspin™による濃縮後にHiTrap™ IgG Sepharose™ FFを用いて行ったプロテインLとZätAのアフィニティークロマトグラフィーの結果を図1と2に示します HiTrap™ MabSelect SuRe™を使用して行ったVivaspin™による濃縮後のCHO細胞培養上清のIgG1の分析結果を図3に示します。
結論Vivaspin™ 2 およびVivaspin™ 6を使用して大腸菌培地およびほ乳動物細胞培養上清中のタンパク質の濃縮を行いました。Vivaspin™を使用して遠心分離することで、培地中の緩衝成分の大半がひとつのステップで除去されると同時に、ターゲット分子の濃縮が行われました。 その後に行ったアフィニティーカラムによるサンプルの分析では、過度のシグナルノイズは生じず、正常なアフィニティークロマトグラフィー曲線が得られました。また、Vivaspin™で濃縮を行うことで、極端に希薄なCHO細胞培養液中のIgG1をアフィニティークロマトグラフィーで定量できるようになりました。 Vivaspin™によりサンプルの不要成分を除去してサンプルの複雑性が低減すると共にターゲット分子の濃縮が行われたため、その後の分析を行いやすくなり、確実な結果を確保できました。
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva