Q (キャプチャー法を使う前提で)アナライトを剥がす方法について教えてください。
A キャプチャー法ではリガンドごと解離させ、次のサイクルでは再びリガンドをキャプチャーさせ直します。
このご質問は、古典的な直接法との違いについてご理解いただくことで解決します。まずは直接法について確認してみましょう。
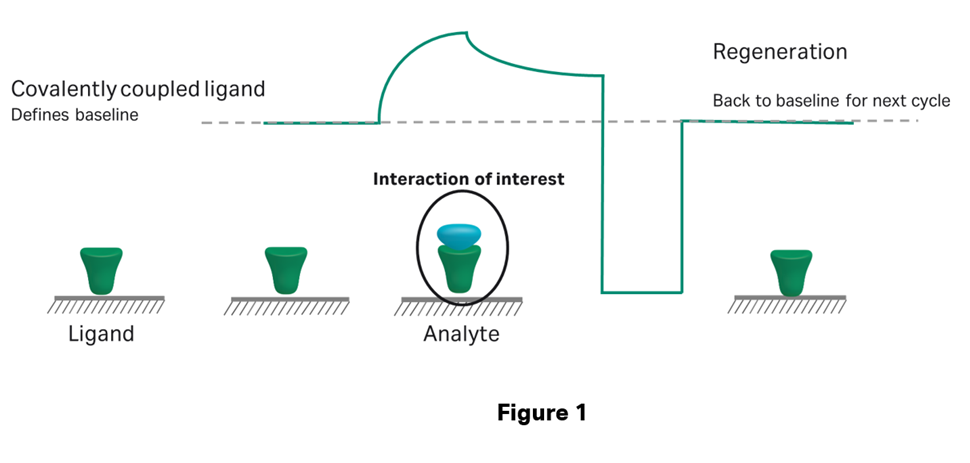
Figure 1のように、直接法とはリガンド分子がセンサーチップ上に共有結合(ほとんどの場合、アミンカップリング)している方法を指します。共有結合ですから、この方法の場合、もはやリガンド分子はセンサーチップ上から解離しません。したがってkinetics / affinity解析のように、異なる濃度のアナライト分子を添加したい場合や、複数の種類のアナライト分子を測定したい場合は、Regeneration(再生)の条件検討が必要になります。
補足:直接法での再生操作について
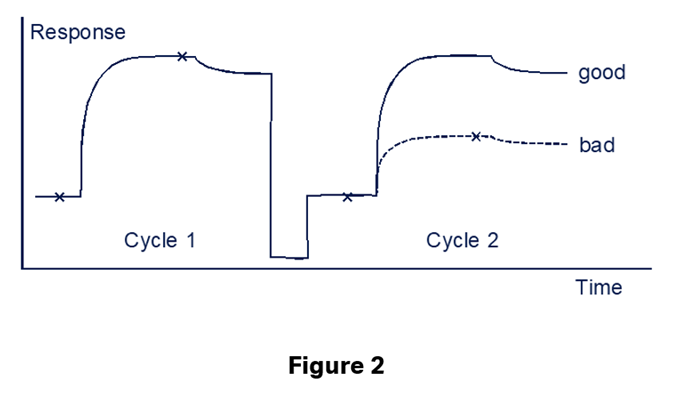
直接法における再生はいくつか注意点があります。①結合してしまったアナライト分子が全て解離することはもちろんですが、②同じ濃度のアナライト分子を再度添加したときに同じセンサーグラムが描けること、これが重要です。Figure 2では、Cycle 1と2で同じアナライト分子を添加しているのですが、badのようですとリガンド分子が再生操作によって失活してしまっている可能性があります。
これでは正しい測定ができません。①、②を満たすような、マイルド過ぎず、かといってハード過ぎない再生溶液を探す…ちょっと考えただけでも条件検討に時間がかかりそうですね。もしかすると、そもそもそのような再生溶液自体見つからないかもしれません。
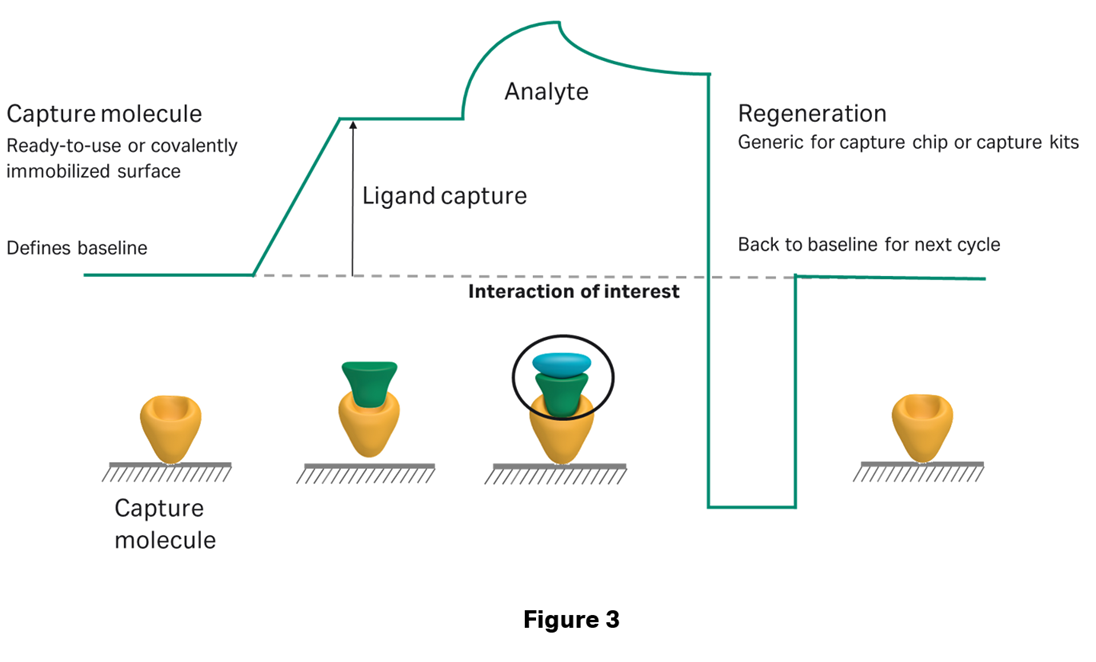
そこで出てくるのがキャプチャー法です。Figure 3のように、キャプチャー法はリガンド分子ごと解離させてしまう方法です。アナライト分子だけ解離させるような方法は取りません。ここで2つの疑問が出てくるはずです。
(1)Capture moleculeからリガンド分子を解離させる条件検討はしなくて良いのか?(2)毎サイクルリガンド分子をキャプチャーさせる際、そのキャプチャー量は揃うのか?の2点です。
(1)に関しては弊社のキットや専用のセンサーチップをご利用いただけるなら、既にキット内に専用の再生溶液が同梱されていたり、あるいは再生条件が決まっているため検討の必要がありません。現在ご利用いただけます製品群は以下の通りです(少しだけ特徴を記載しておきました)。
| 製品名 | 特徴 | |
|---|---|---|
| ⅰ | Biotin CAPture Kit | Sensor chip、再生溶液、特殊なReagentで構成されているキットです。このキット以外に必要な消耗品類はありません。一番のオススメです。ほとんどの測定に対応します。詳細はこちらをご参照ください。 |
| ⅱ | 再生溶液、抗抗体、抗抗体の希釈用バッファーで構成されているキットです(GST Capture Kitのみ別の試薬もあり)。このキットの他、Sensor chip、Amine coupling kitが必要になります。各種抗抗体でキャプチャーできるリガンド分子に対応します。 | |
| ⅲ |
|
Sensor chipのみです。Protein A、G、Lがプレイモビライズされており、抗体を取り扱う測定に便利です。再生溶液は別途ご用意いただく必要がありますが、それぞれの製品説明書に記載されています。 |
| ⅳ | Sensor chip NTA + NTA Reagent Kit | NTA Reagent KitはNi solution、再生溶液で構成されています。これにNTAがプレイモビライズされたSensor chipと合わせてHisタグ付き分子をキャプチャーするのにご利用いただけます。 |
(2)に関しても非常に精度よくキャプチャー量が揃ってくることが分かっておりますので安心してご利用ください。複数回データを取得して、徐々にキャプチャー量が下がってくるなどの影響が出始めたら新たに同じ消耗品をお求め頂くと良いです。
アッセイ系構築に掛かる時間を圧倒的に短縮できるうえ、リガンド分子自体も毎回フレッシュなものがキャプチャーされるので正しい相互作用を測定しやすい、配向性も揃いやすい、リガンド分子の溶液が少しクルードでもセンサーチップ表面で簡易精製されるので非特異的な結合を抑制しやすい…と良いことばかりです(直接法に比べたらリガンド分子の消費量が増えることはデメリットですが、そもそもBiacoreのご測定で使用する量はそれほど多くないので問題にならないはずです)。したがって、アッセイ系は基本的にキャプチャー法が第一選択肢です。ぜひ便利な各種消耗品をご利用ください。
最後に
アッセイ系構築に関しては目的別に最適な方法があります。ぜひ「必見!Biacore™戦略と測定条件のワークフロー」Webinarもご覧ください。資料もダウンロードいただけます。