さまざまな手法を用いて分子の構造・機能を明らかにしようとしている皆さまにとって、Biacore™はその中の一つに過ぎません。たまに、他手法ではくっつくはずなのにBiacore™でつかない。とか、明らかに弱い。と思った経験はありませんか?
活性濃度の概念から考察すると原因と対策が出てくるかもしれません。
例えば、
- 酵素アッセイにおいて阻害活性あるのにBiacore™でレスポンスがでないんだよな…
- どう考えてもアフィニティが弱すぎる…
というようなことです。
もちろん測定手法が異なりますので、それぞれに擬陽性、偽陰性は存在し、またアフィニティの強さの違いなどが異なることは、ある意味当然起こりうることなのかもしれません。しかし、もしBiacore™測定に必要な条件の不備によってあるはずの結合が観察できなかったのだとしたら。。。多くのケースで疑われる原因に、アナライト/リガンドの活性濃度/密度が想定した値より実際は低かった。という状況があります。
では、“想定した濃度/密度”とは何を指すのでしょうか?
アナライト濃度の場合は吸光度測定のA280で定量した濃度を用いている方も多いかもしれません。また想定したリガンド密度としてはどうでしょう。
Biacore™の場合はリガンド側を固定化しますので、固定化(キャプチャー)量[RU]がこれに相当します。
本記事では、これらの想定値に対して、実際の活性濃度/密度が低いとどのようなことが起こるか、そしてそれに対する対策についてお伝えしたいと思います。簡単な方からお伝えしたいと思いますので、以下の順ですすめます。
- リガンドの活性密度が低い場合
- アナライトの活性濃度が低い場合
リガンドの活性密度が低いとどうなるか?その対策
まず「Rmaxのトリセツ」で解説しております、各種Rmaxの概念を理解する必要があります。
リガンドの活性密度が想定より低いという状態は、言い換えると固定化したリガンドのうち、たった○○%しか生きていない(結合活性を有していない)、ともいえます。この○○%のことをActivityと呼ぶことがあり、以下の式で定義されます。
Activity (%) = 100×(実測Rmax/理論的Rmax)
“くっつくはずなのにレスポンスが出ない”は上式でいうと実測Rmaxが装置のノイズ以下の大きさになってしまった状況です。
Biacore™装置は低分子化合物の結合も十分に検出できる感度を有していますが、その理論的Rmaxは例えば20RU程度になることも多くあります。仮に固定化されたリガンドの標的分子のActivityが1%しかなかったとしたら、実測のRmaxは0.2RUになり、これでは何か結合しているな、というのはわかるかもしれませんが、KD値を出すことができるようなRmaxとは言えません。
さらにActivityが1%ということは残りの99%は結合活性を持たない変性タンパク質だ、ということになりますので、このような場合は、低分子化合物が変性タンパク質に非特異的結合を起こし、評価に値するようなセンサーグラムにならなくなってしまうことも多くあります。
対策としては、以下にActivity(%)が高くなるようなサンプル調製や固定化アプローチをするか、ということになります。Biacore™の古典的な固定化方法であるアミンカップリングは現在も有用な方法の一つではありますが、固定化に伴ってリガンドタンパク質を変性させてActivityを下げる可能性が比較的高い手法です。ですのでもし、レスポンスが観察されないで、アミンカップリングを適用しているようでしたら、各種タグを利用したキャプチャー法による固定化法に切り替えるのは一つの有力な対策です。
ところで、このようにリガンドのActivityが実験によって異なる可能性があるのに、信頼できるKDが求まるの?というご質問をよく受けます。
これにお答えするとしたら、理論的には求まります、ということになります。(あえて“理論的には”としているのは、上記の非特異的結合のような問題が起こることなどがあるからです)
このご質問は、分子AとBを溶液系で測定する場合とBiacore™のようなリガンド固定化系で測定する場合の違いともいえるかもしれません。またBiacore™Simul8を使ってご説明したいと思います。Fig 1には、実測Rmaxが異なる(10RUと20RU)、つまりActivityが2倍異なるがそれ以外は同一の相互作用をシミュレートした結果をお示ししています。
異なっているのはリガンドの活性密度だけです。ところがセンサーグラム形状としては相似形で、それぞれのアナライトが平衡に到達するまでの時間や、実測Rmaxに対する相対的な高さや、Rmaxに対する相対的な解離速度は同じであることが分かると思います。このことはつまりRmaxが異なったとしても(Activityが異なったとしても)、理論的には同じka,kd, KDを算出する、ということを意味します。
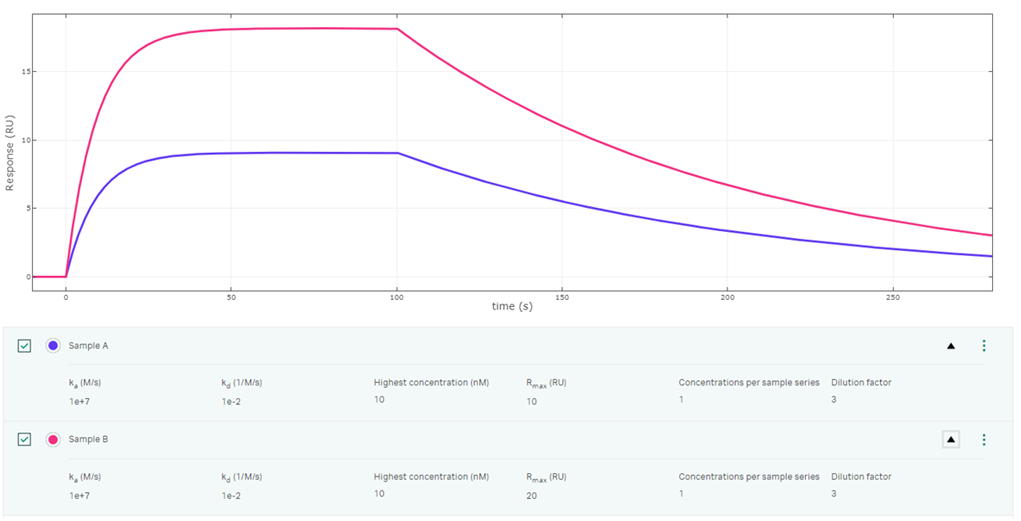
Fig1:実測Rmaxだけが異なり、同サンプル・同条件のセンサーグラム形状の違い
アナライトの活性が低いとどうなるか?その対策
アナライトの活性濃度が例えばA280で求めた濃度より実際は低かったらどうなるでしょうか。実はこちらの方が、気づかないうちにkaやKDの値を正しくない値として算出してしまう可能性がある怖い要素です。Fig 2をご覧ください。これはPapainを固定化して、アナライトとしてCystatin BのWild typeと各種mutantを添加したときのセンサーグラムです。いかがでしょうか。どれもまあまあきれいにフィッティングがかかっていて、出てきた数値は採用していいかな、と思えませんか?
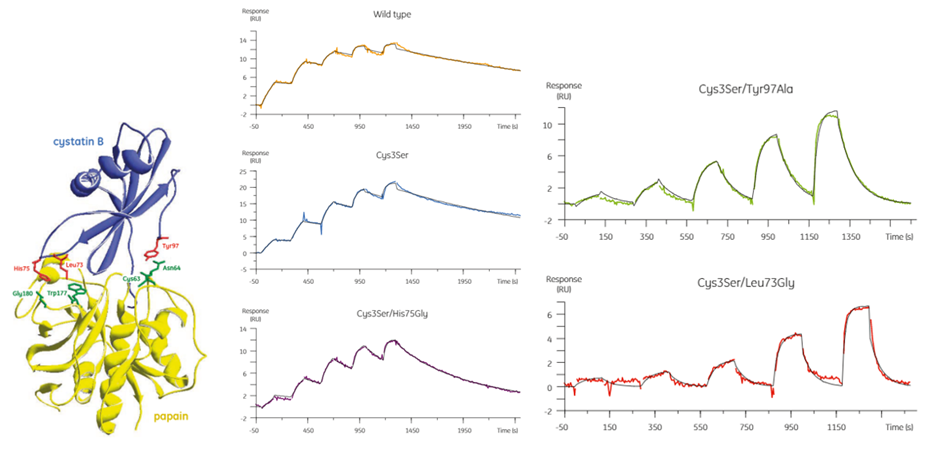
Fig2:Cystatin Bの wild typeと各種mutantの相互作用
ところが実はこの測定の場合、Cys3Ser/Leu73Glyで当初A280から求めた濃度値から算出されたka、KDは全く正しい値ではないことが分かりました。
これを明らかにしたのが、Biacore™ T200, X100 plus packageに搭載されている機能(2021年7月現在)であるCFCA(Calibration-free concentration analysis)を用いたアナライトの活性濃度の定量法です。CFCAの詳細な原理のご説明は今回は省きますが(もしご興味ありましたら弊社サポート窓口Tech-JPまでお問い合わせください)、その名の通り、標品/検量線が無くとも結合活性のあるタンパク質の濃度を測定する手法です。
この手法によってCys3Ser/Leu73GlyはActivity(%)がたったの9%しかないことが分かりました。そこで、A280で求めた濃度値に対して0.09をかけた値を真の濃度として、フィッティング計算をして確からしい数値を求めることができた一例です。このCFCAで求めた濃度値を用いたフィッティング計算で得られたka、kd、KDともし、A280の濃度値で計算した場合を比較してみたいと思います(Table 1)
Table 1:活性濃度が9%しかなかったときのフィッティング計算値の違い
| ka | kd | kD | |
|---|---|---|---|
| CFCA | 1.1 × 10^6 | 2.3 × 10^-2 | 2.2 × 10^-8 |
| A280 | 9.9 × 10^4 | 2.3 × 10^-2 | 2.3 × 10^-7 |
このことはいかにタンパク質調製とサンプルの品質管理が大切かを物語っています。もしアナライトのサンプル調製ロットや保存期間が異なると算出値が異なる、なんてことがあったら、アナライトの安定性と調製方法見直してみると解決するかもしれません。
最後に、このようなタンパク質の品質(結合活性・活性濃度)に関する議論、方法論は、近年Biacore™でも適用が拡大しているバイオ医薬品の品質管理の分野で進んでいます。Cytivaでも例年バイオ医薬品の品質評価に関するワークショップを開催しています。普段基礎研究をされている皆様ももしご興味がありましたらそちらの測定世界も是非覗きに来てください。