ついついka、kd、KDばかり注目しがちですが、Rmaxもとっても重要です。その意味と使い方を理解すると測定データからいろいろな情報を得ることができるのです。
Biacore™をお使いの皆様、”Rmax”って何?と聞かれたらなんと答えますか?きっと”アナライトの最大結合レスポンス”と答える人が多いのではないかと思います。・・・正解です!
でもこのRmaxには3つの意味があるのです。これらをこの3つに分けて考えると、Rmaxを余すところなく利用してデータの解釈ができるようになります。今回はそんな話をしてみたいと思います。
- 理論的Rmax (Theoretical Rmax)
リガンド固定化量とアナライト・リガンド分子量、リガンドの結合価数 (s)から計算される値
Rmax = リガンドの固定化量 × (アナライトの分子量/リガンドの分子量)× s *) - 実測Rmax(Observed Rmax)
実測定でアナライトを高濃度添加したときに実際に飽和する結合レスポンス高。 - Fitting 解としてのRmax
実測定でFitting計算をしたときにka、kd値などとともに算出される変数Rmaxの解
これらの用語自体はBiacore™の資料や論文などによく使われるようなものではありませんが、それぞれの概念を理解することは大切です。
*)surface density calculatorを用いて自動計算可能です。
それでは、これら3つのRmaxを使いこなして、どのような情報が得られるようになるかというお話に移りたいと思います。以下に代表的な使い方を記載しました。
- 得られているセンサーグラムの結合部位特異性の確認
- リガンドの結合活性率の算出
- 高濃度帯において非特異的結合が発生する場合の解析:steady state affinity constant Rmax
- 結合価数の推定
まず1.の使い方が最も基本的でよく使うものです。
Biacore™はka、kdやKD値を求めるために用いることが多いですが、そのために必須となる条件は、取得したセンサーグラムが結合部位特異的な相互作用を反映したものである、ということです。言い換えると非特異的結合成分の多いセンサーグラムにいくらフィッティング計算をしても意味のある数値を算出することは不可能です。このとても重要な結合部位の確認手法として、以下の式があります。
実測Rmax≦理論的Rmax
少なくともこれを満たしたセンサーグラムのデータセットが初めてka、kd、KDの解析をする意味を持ちうります。
さて、このことは大変基本的かつ重要なことなのですが、今回さらにもう少し踏み込んで、さらにセンサーグラムの形状から”あ、これノンスぺが入っているな”というのを見るコツを少しお話したいと思います。
Fig.1に、5濃度のセンサーグラムセットのうち高濃度側2濃度に色付け(赤と青)したものと、点線で表したものを描きました。このように非特異的な結合(が含まれる場合)は理論的Rmaxを超えたレスポンスを示す上に、結合相、解離相ともに” 二相性”を示すことがよくあります。(注:本来の特異的結合様式が1:1ではない場合は二相性の形状だけで非特異的結合とは言えないときもあります)
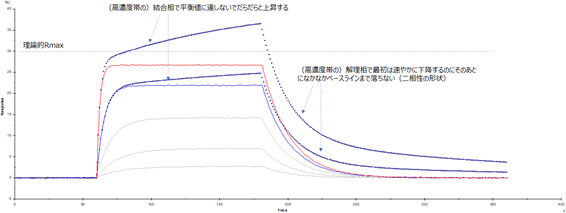
Fig.1
次に2.の使い方をご紹介します。
ポジティブコントロール(以下ポジコン)がある場合、最初にポジコンのデータを取得したのち、それ以外のアナライトの測定のために固定化量を調整することがあると思います。その時にリガンドの結合活性率
Activity (%) =(実測Rmax/理論的Rmax)×100
を計算しておくと、狙いたい固定化量を考えるときに便利です。例えばリガンドの結合活性率が50%であれば、理論的Rmaxから計算した狙いたい固定化量の2倍を実際には狙うと適当だということになります。
また、一般的に結合活性率が低いようなセンサーチップ表面は、非特異的結合を誘発しやすく、正確なデータを取得するための障害になるリスクが高くなります。従ってポジコンを測定したときに、結合活性率が低いことに気づいた時には、固定化方法を変えたり、リガンドそのものの調製方法をより品質の高いものに変えるように変更することを早期に変えることを検討したほうが、その後のアナライト測定のデータを正確に測定するための近道になるかもしれません。
また、少しわき道にそれますが、Binding levelスクリーニングを実施するときに最初の方のサイクルに比べて最後の方のサイクルのActivityが減少することがありますが、Biacore™8K/8K+やT200、S200ではこの標的分子のActivityのサイクル依存的な減少分の結合レスポンスの変化をノーマライズする機能(Control adjustment) が搭載されており、最初の方のサイクルと後ろの方のサイクルの結合レスポンスを公平に評価することが可能です(スクリーニング全体の” ばらつき”についてはZ’-factorなどでご確認ください)
次に3.の使い方をご紹介します。
弱い相互作用で箱型のセンサーグラムの解析するときはアフィニティ(平衡値)解析が適用となります。その時には必然的に高濃度のアナライトを添加することになりますので、しばしば非特異的なレスポンス成分が高濃度添加時に混ざってきて、うまくレスポンスがRmax近くで飽和しないときがあります。そのような時でも、確かに特異的な結合成分は観察されていると思われる(例えばポジコンの競合阻害などで)のにも関わらず、高濃度側の非特異的結合成分のために数値化されたKDが大きく見積もられている可能性があって困るときがあります。特にFragment Based Drug Discovery (FBDD)において、アフィニティの弱いフラグメントHitのKD値算出の際にこのようなことは起こりがちです。
アフィニティ解析は平衡値プロットに対して以下の関数をフィッティングします。
Req = Conc*Rmax/(Conc+KD)+offset
ここで変数はKDとRmaxとoffsetになります。目的のアナライト検体の実測Rmaxは飽和プロットが取得できないと本当は知ることはできませんが、もしポジコンから2.で述べたActivityが分かっていれば、各アナライト検体の理論的Rmaxから計算値として求めることができます。このRmax値を上記関数中に定数(constant)として代入することで、関数中の変数の数が少なくなりますので、取得したいKD値の信頼性が向上します。
Fig.2では、同一の平衡値プロットに対いてRmaxを変数とした場合と定数とした場合での結果を比較しています。
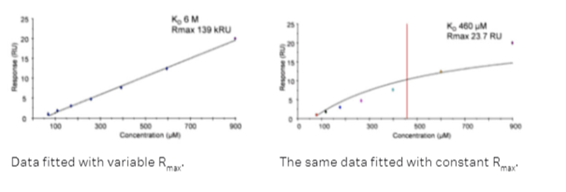
Fig.2
最後に4.の使い方をご紹介します。
一般的にBiacore™の原理上リガンドに対してアナライトがいくつ結合するかを直接的に知ることはできないとされています。
確かに単一のアナライトとの相互作用データしかなければそれはわかりません。しかしながら、(例えばポジコンの結果から)リガンドのActivityが分かっていれば(理想的には100%)、本稿の最初に述べた理論的Rmaxの算出式から結合価数sに対する確からしい情報を得ることができます。
4月の月刊Biacore™コンシェルジュの紹介論文では、2つの抗体の 標的タンパク質(三量体)への結合価数をHDX-MSの情報や各抗体のRmaxの比較から(そしてこれが抗体の臨床的な効果と関連していると)論じています。よろしければぜひそちらもご覧ください。
Epitope and Paratope Mapping by HDX-MS Combined with SPR Elucidates the Difference in Bactericidal Activity of Two Anti-NadA Monoclonal Antibodies J. Am. Soc. Mass Spectrom. 2021