おさらい:キャリーオーバーとは?
キャリーオーバーとは、ニードルや流路の残留物が次のサイクルに影響を及ぼすことです。キャリーオーバーの残留物は大きく分けて2種類あり、1つはstickyな低分子化合物が流路壁面やニードルに付着したもの(Carry-over controlとExtra wash編参照)、もう1つは直前の添加工程に関連する溶液がニードル表面に微量に付着するものがあります。
Stickyな低分子化合物の場合:
- Stickyな低分子化合物を利用する際には、キャリーオーバーの検証方法として“carry-over injection”コマンドがありました。フラグメントや低分子Screeningのテンプレートにはあらかじめ組み込まれており、一方でCharacterizationのテンプレートには組み込まれていませんでした。バッファーボトルから添加されるため、バイアルやウェルにランニング緩衝液を用意することはありません。このランニング緩衝液はチップ上を流れ、レスポンスが出ないことを確認します。
- こうしたstickyな低分子化合物への対策方法は“Extra wash”コマンドでした。フラグメント・低分子を取扱う場合はどのテンプレートにもあらかじめ組み込まれていました。50% DMSOをバイアルやウェルに用意します。この50% DMSOはチップ上は流れず、フローシステムのみを洗浄します。
直前の添加工程に関連する溶液の場合:
- 直前の添加工程に関連する溶液に関しては、場合によってはstickyな低分子化合物の時と同様にExtra washコマンドを利用することもありました。
- Biotin CAPture Kitを利用する場合にはランニング緩衝液、SAチップなどにビオチン標識サンプルを固定化する際には50% Isopropanol、抗体をキャプチャーする際にまれに50mM NaOHでのExtra washが使われることがありました。
- 今回取り上げる“Predip”も「直前の添加工程に関連する溶液」を対策するためのオプションです。Extra wash以外の対策方法になります。
Predipとは?
今回の本題です。Predipとはニードルがバイアルやウェルから溶液を吸引する際に選択できるオプションで、「これから添加したい溶液と同じ溶液が充填されたバイアルやウェルに、一度ニードルをディップする動作」です。すぐ想定されるように、直前の添加工程で使用した溶液が洗い流されるわけですから、溶液が希釈されたり、コンタミを防ぐのにも有効です。結果的にキャリーオーバーを防ぐことになります。
どんなケースに利用されますか?
機能的にはニードルがバイアルやウェルから溶液を吸引するコマンド<補足>全てに対してPredipのオプションを利用できます。
多くのコマンドでPredipのオプションがある一方で、利用するシーンは割と限られます。一言で言ってしまえば、同じバイアル/ウェルから何回も溶液を取得する際にPredipを使うと良い、となります。この解説をするにあたり、キャプチャー法について理解を深めておきます。
<補足>
- ニードルがバイアルやウェルから溶液を吸引するコマンド:Analyte, Single cycle kinetics, A-B-A, Dual, Capture, Enhancement, Regeneration, Generalです。
<補足の補足>
- 正確に言うと、これらのコマンドのうち、Analyteに関しては3つのinjection方法(Fast injection, Low sample consumption, High performance)があり、Fast injectionだけはPredipのオプションが存在しません。
<補足の補足の補足>
- 因みにこの3つのinjection方法の違いはエアーセグメントの数の違いです。溶液を添加する際は吸い上げた溶液をそのまま添加すると流路に残存していた溶液と混じってしまうなどで濃度が変わったり、コンタミしたりしてしまいますよね。そこで始めに溶液を少しだけ吸った後、空気の層を挟み、再び溶液を吸っています。この僅かな共洗い用の溶液と空気のサンドイッチの数が少ないのがFast injectionで、Fragment clean screenの時に用いられます。少し多いのがLow sample consumptionでCaptureコマンドの添加時や低分子スクリーンの時に用いられ、さらに多くなるとHigh performanceで、正確なデータを出したいMulti cycle kineticsなどに用いられます。つまりデータの質を高めたい測定(≒センサーグラムの形状そのものが重要な測定)ほどエアーセグメントの数が多いinjection方法を取るということです。ここまでご覧いただけたあなたはぜひBiacore™本体のニードルの動きをじっと見つめてみてください!同じバイアルやウェルにニードルが何回も挿入されていることがお分かりいただけるはずです。
一言にキャプチャー法といってもリガンドとアナライトのどちらを調べたいのかで違いがあります
Figure 1は一般的なキャプチャー法の模式図です(参考:必見!Biacore™戦略と測定条件のワークフロー)。
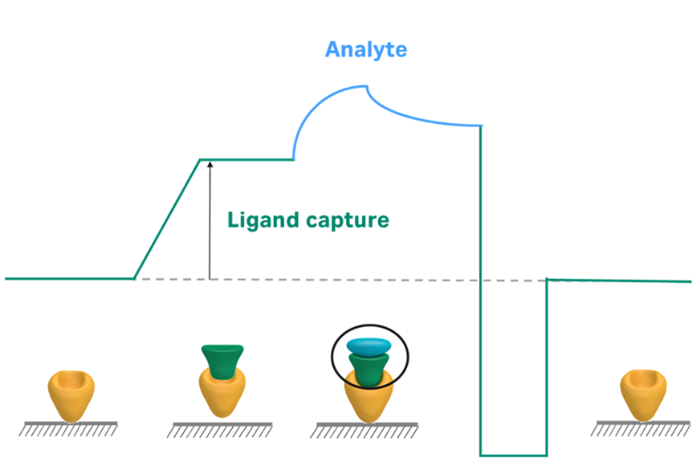
Figure 1:一般的なキャプチャー法の模式図
キャプチャー法は様々な種類がありますが、基本的な動きは何らかのタグをひっかけられるCapturing molecule(黄色)をチップ上に保持しておき、そのタグが付与されたリガンドをキャプチャーし(緑色)、アナライトを添加(水色)、最後にRegeneration溶液を添加してリガンドキャプチャー前に戻るという流れを取ります。毎サイクルでフレッシュなリガンドをチップ表面に保持することができますので、再現性も良い上、リガンドからアナライトを解離させるための条件検討の時間を丸ごと削除できる点が強み<補足>です。
<補足>
- リガンドは一度キャプチャーしたら測定中ずっとそのままではなく、サイクルごとにリガンドごと再生し、次のサイクルでは再びリガンドをキャプチャーさせ直すようにします。お問合せなどで時々リガンドを解離させないキャプチャー法を拝見することがありますが、これは一般的な方法ではありません(リスクをご理解いただいて実施されているのであれば問題ございませんが…)。
リガンドは1種類でアナライトが複数種類あるパターン
例えば低分子測定のキャプチャー法がこれに該当します。抗HA抗体をSensor chip CM5にアミンカップリングし、HAタグ付きのリガンドタンパク質をキャプチャー、さまざまな低分子アナライトを測定するパターンです。この実験系の場合、HAタグ付きタンパク質は同じバイアルなどにプールされており、毎サイクルCapturing moleculeの上に添加することになります。プールされた溶液が徐々に希釈してしまう、またはコンタミしてしまったら…?もちろん実験系が成り立ちませんね。であればPredipの出番、ということになります。Figure 2ではCapture 1のコマンドにおいてPredipが入っています。
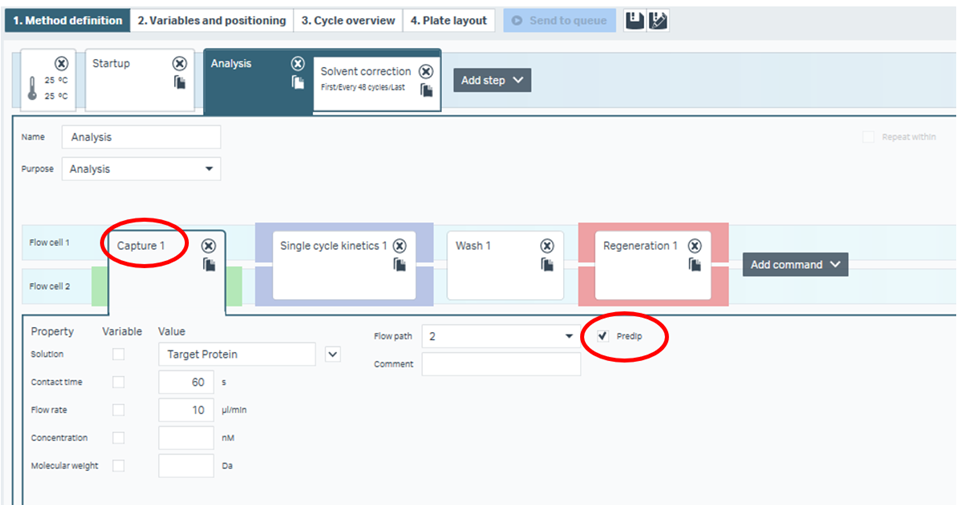
Figure 2
リガンドが複数種類でアナライトは1種類のパターン
例えば抗体のスクリーニングがこれに該当します。Sensor chip CM5上に抗抗体などがアミンカップリングで固定化されており、様々な抗体をキャプチャー<補足>、1種類の抗原を一定濃度で添加して1濃度だけのKinetic screenを実施するパターンです。この実験系の場合はアナライトがプールされていることになりまして、この場合はアナライトをPredipするようになっています。
<補足>
- ここでキャプチャーされる抗体は精製済みでも良いですが、例えばハイブリドーマ細胞の培養上清なども利用できます。
<補足の補足>
- 細胞培養上清を利用する場合は1000 x g を超えない範囲で3-5min程度実施すると良いです。流路の詰まりが気になる場合は、そのあと更に0.22μmのフィルターを通しても良いです。
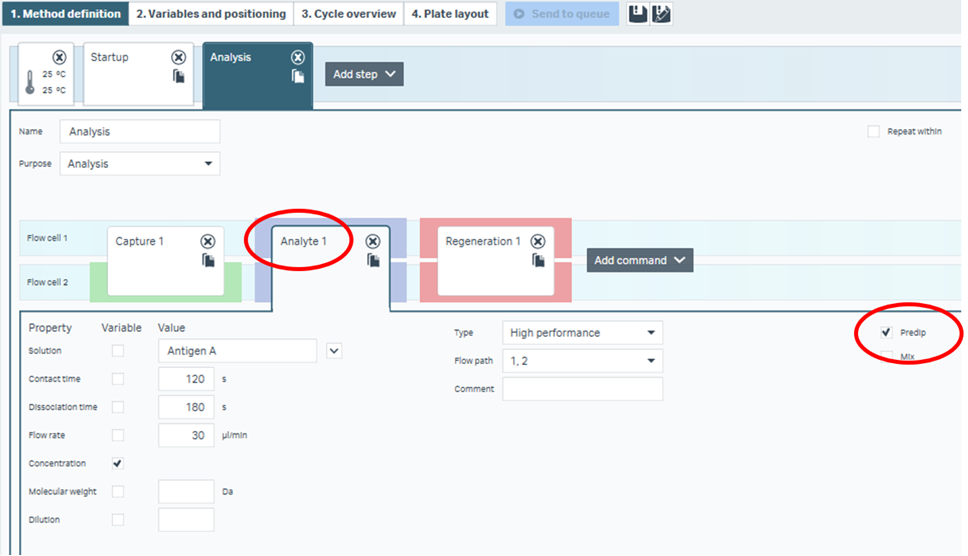
Figure 3
まとめ
上記をまとめますと、以下のようになります。少し補足もしておきます。
- Predipの目的は、同じバイアル/ウェルから溶液を複数回取得する際に、直前の動作によるニードルに付着した溶液によって、そのバイアル/ウェル中の溶液が希釈・コンタミすることを防ぐことである。
- Predipはニードルがバイアルやウェルから溶液を吸引するコマンドのほとんど全てに対してPredipのオプションを利用できる。
- 一方で利用するケースは同一の溶液を用意する際のCaptureコマンドやAnalyteコマンドであり、普通はそれ以外のコマンドには用いられない(例えばRegenerationも同一の溶液を同一のバイアル/ウェルにセットするが、ここでは普通はPredipは用いられない)。
- (補足)Predipの溶液量は「Full」と記載されていますが、上記の目的によりニードルが浸かるくらいまで充填しておくと良い…大体8割くらいを目安に。
- (補足)Predipは貴重なサンプルをかなり消費するので、研究者は得たいデータの精度/厳格さとトレードオフで実施する/しないを選択する。
- (補足)同一のバイアル/ウェルから溶液を取得する場合はゴム製のキャップ/セプタを使用すること。
以上、前回(Carry-over controlとExtra wash編)と合わせて2回にわたりキャリーオーバーを防ぐ解説を行ってまいりました。普段、何気なく用意している溶液の目的がご理解いただけましたら幸いです。