はじめに
リガンドとアナライトの結合特異性を評価する上で確認しなければならないことの一つが、「結合部位特性」です。アナライト添加濃度を上げていった際、理論的Rmax以下で飽和することを確認していただきます(Figure 1)。「実測Rmax ≦ 理論的Rmax」という表記を目にすることも多いかと思います。
理論的Rmax:リガンド分子にアナライトが全て結合した時に得られる理論上最大のレスポンス(RU)
実測Rmax:実際にアナライトを添加した時、結合量が飽和するレスポンス(RU)
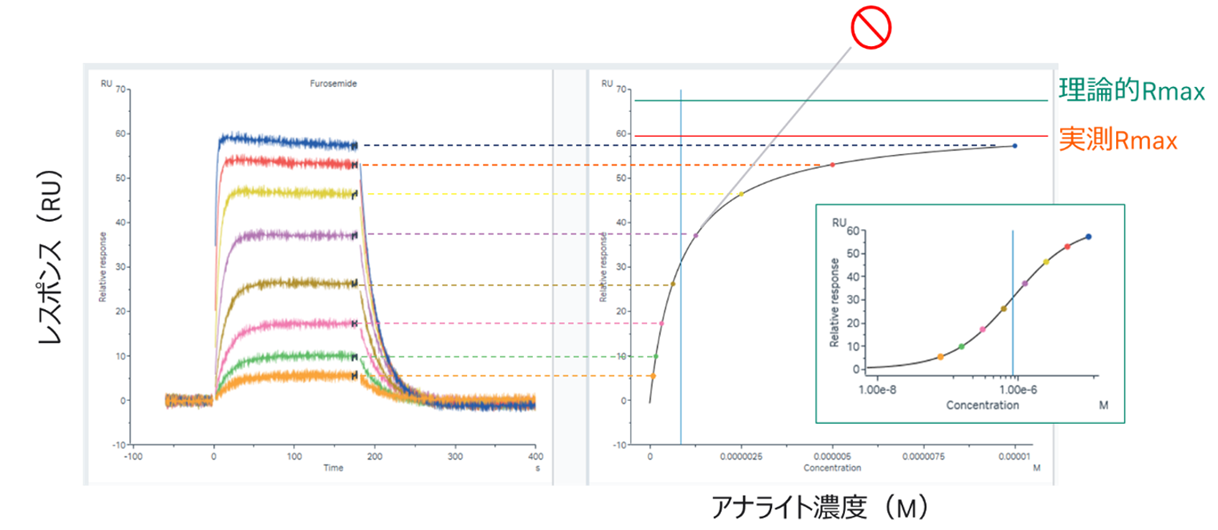
Figure 1 結合部位特性の確認。「実測Rmax ≦ 理論的Rmax」
Rmaxに関する詳細は既出記事「Tips・FAQs - Rmaxのトリセツ」をご覧ください。
低分子化合物の測定において、複数濃度の化合物アナライトをインジェクションして飽和に向かっていく様子が確認できるのに、実測Rmaxが理論的Rmaxを上回ってしまうケースがあります。
表面プラズモン共鳴(SPR)のおさらい
ここでBiacore™ の検出系である、表面プラズモン共鳴(Surface Plasmon Resonance, SPR)についておさらいします。Figure 2のようにセンサーチップのリガンド固定化面の裏側から一定の角度範囲の偏光を照射し、全反射した反射光強度の極小点の角度(共鳴角)変化からセンサーチップ表面近傍の屈折率(密度)変化を検出しています。この密度変化を時間に対してプロットすることでセンサーグラムが得られます。
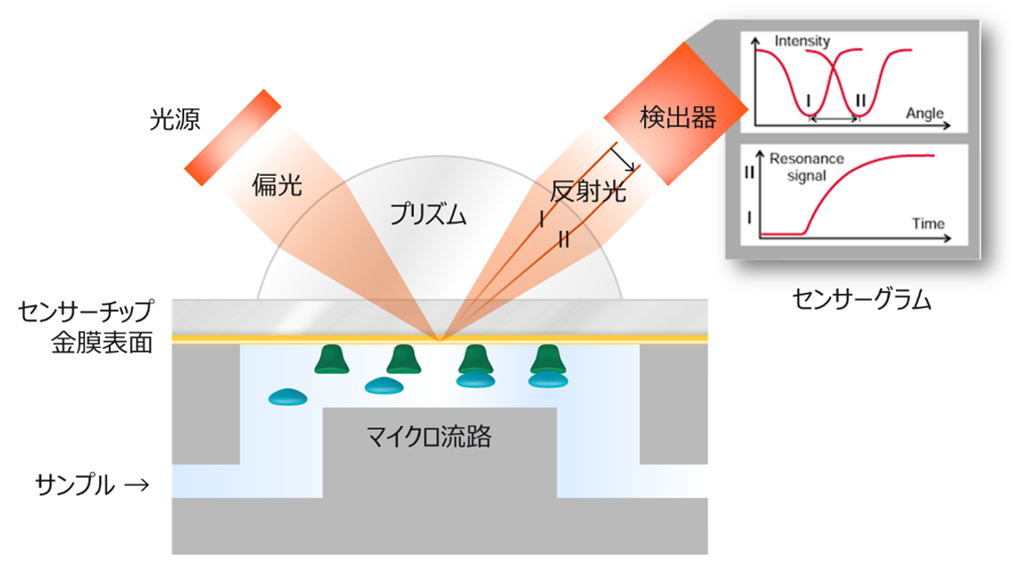
Figure 2 Biacore™ の検出系、表面プラズモン共鳴(SPR)
センサーチップ表面近傍の溶液密度変化はこの共鳴角と正比例の関係にあり、共鳴角0.1°の変化を1000 RU (Resonance Unit)と定義しています。また、タンパク質において1000 RUはおよそ1 ng/mm2に相当します。しかしながら下記の通り、低分子化合物において、1000 RUが1ng/mm2から外れる場合があります。
と、申しますと測定の信頼さえ疑いたくなりますが、Biacore™ で求めるka, kd, KD値などは1000RUが1ngであろうが2ngであろうが関係なく、金膜近傍の溶液密度(屈折率)変化は共鳴角と「正比例の関係にある」ということが重要のためご安心ください。
低分子化合物における屈折率濃度増分(RII)
屈折率濃度増分(Refractive Index Increment、RII)とは、dn/dc(屈折率n、濃度c)で示される濃度に応じた溶液の屈折率変化を示す値です。タンパク質ではほとんどの場合、同じような値となりますが、低分子化合物の場合、その構造や原子組成によって異なる値を取ります。特に芳香族化合物とハロゲンを含む化合物では最大で2倍程度RIIの違いがあります。また、緑色や青色の有色化合物にもRIIが高いものがあります。
Analytical Biochemistry 284, 348–353 (2000)
Determination of the Refractive Index Increments of Small Molecules for Correction of Surface Plasmon Resonance Data
こちらの論文では、Table2にBSAと各種化合物のRIIを比較した一覧が示されています。また、「RI increment ratio vs BSA」という欄から、特にRIIの大きいBerenilは、BSAの2倍の値を持つことが示されています。さらに、論文中の式[3]では、RIIを加味したRmaxを計算方法が記載されています。
Biophysical Journal Volume 100 May 2011 2309–2317
On the Distribution of Protein Refractive Index Increments
こちらの論文では、タンパク質についてはRIIの分布が非常に狭いことが示されています。
このように、低分子化合物では濃度に応じた屈折率変化の大きいものも存在し、それがBiacore™ のレスポンス(RU)に反映されます。そのため、「実測Rmax ≦ 理論的Rmax」に当てはまらないケースがありますのでご注意ください。高濃度の化合物アナライト添加によって結合レスポンスが飽和する様子が確認できれば、理論的Rmaxの2倍以下程度の実測Rmaxを許容するケースがあります。
Biacore™ では、構造の推定はできませんので、早い段階で構造解析を行っていただくことをお勧めします。