Biacore™の特長の一つは豊富なセンサーチップの種類です。分子の種類によって適切な手法が選択でき、また、うまくいかなかった場合でも次に試すべき選択肢が用意されています。あらためてセンサーチップの基本と使用事例を見ていきましょう。
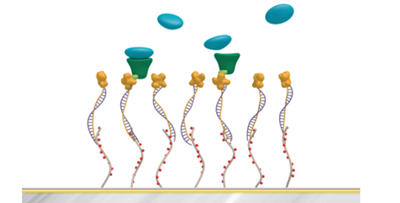
センサーチップは機種によって形状が異なります(図1)。必ずご利用の装置に適したものをご購入ください。現在、全部で15種類ほどのラインナップがございます。

図1:Sensor Chipの概観
(A) Series S Sensor Chip:Biacore™ 1 series、Biacore™ 8 series、Biacore™ T200/T100、Biacore™ S200、Biacore™ 4000/A100で使用
(B) Sensor Chip:Biacore™ X100のほか、Biacore™ 3000以前のモデルで使用
センサーチップ一覧
Sensor Chipを一覧にまとめました(表1)。キャプチャー法に用いる修飾済みのセンサーチップに関しては、ベースとなるSensor Chipの種類が異なりますのでこちらもご参考にしてください。
表 1:Sensor Chipの種類
Sensor Chip NAおよびSensor Chip PrismAはSeries Sのみの取り扱いです。Sensor Chipはいずれも2~8℃保存ですが、Sensor Chip PEGのみ-20℃保存ですのでご注意ください。
| Sensor Chip | ベースのSensor Chip | 概要 | 主な用途およびTips |
|---|---|---|---|
|
Sensor Chip CM5 | カルボキシメチル(CM)基を導入したデキストランをつけたタイプ。 | 主にタンパク質のアミノ基を利用したアミンカップリングに用います。リガンドの直接固定化のほか各種Capture kitと組み合わせて使用します。 |
|
Sensor Chip CM7 | CM 基の密度が高いタイプ。(最大固定化容量:CM5の約3倍) | レスポンスが小さくなりがちな低分子やフラグメントの測定において、CM5では十分な固定化量が足りない場合に使用することがあります。ただし、現在の十分な感度を持つBiacore™ システムにおいて、CM5で全くレスポンスが見られないものがCM7ならば見られるようになるほどの差にはなりにくく、利用されるケースは限定的と言えます。 |
|
Sensor Chip CM4 | CM 基の密度が低いタイプ。(最大固定化容量:CM5の 約1/3) | 夾雑物やアナライトが電荷をもち、センサーチップへの非特異結合が大きい場合に利用されます。 |
|
Sensor Chip CM3 | CM デキストランが短いタイプ。(最大固定化容量:CM5の 約1/3) | ウイルス粒子などアナライトが巨大な場合や、デキストランマトリクスへの非特異結合を抑えたい場合に利用されます。 |
|
金膜 | 金膜にCM基を直接導入したタイプ。CM基を平面で配置。(最大固定化容量:CM5の 約1/10) | アナライトが巨大な場合や、デキストランマトリクスへの非特異結合を抑えたい場合に利用されることがあります。 |
|
Sensor Chip PEG | デキストランの代わりに短いポリエチレングリコール(PEG)を付けたタイプ。CM基を平面で配置。(最大固定化容量CM5の約 1/10) | アナライトのデキストランマトリクスへの非特異結合が問題となる場合に利用されます。C1と比べ、血漿サンプルを流した時に金膜への疎水吸着が低いことが知られています。極限まで固定化量を抑えた測定でセンサーグラムの変形が改善するケースがあります(詳細下記)。 ※注意:-20℃保存です(その他は2~8℃保存)。 |
|
Sensor Chip CM3 | ストレプトアビジン(SA)を固定化したタイプ。 | ビオチン標識されたリガンドを用いる場合に利用されます。特に核酸を測定する際は、通常末端がビオチン標識された核酸をリガンドとすることが多いです。 |
|
Sensor Chip CM5 | ニュートラビジン(NA)を固定化したタイプ。 | SAと同様に、ビオチン標識されたリガンドを用いる場合に利用されます。SAに含まれるRYD配列と低分子アナライトの非特異結合が問題となる場合に利用されます。再生溶液によく用いられる酸などの耐性が低いため、主に再生不要な低分子化合物スクリーニングで運用されます。 |
|
Sensor Chip CM5 | Biotin CAPture kit付属、一本鎖オリゴDNAを固定化したタイプ。相補鎖DNAによるSA導入が可能です。 | SAと同様に、ビオチン標識されたリガンドを用いる場合に利用されます。センサーチップをキット内の再生溶液により一本鎖オリゴDNAの状態に容易に再生可能なため、再生してアナライトの濃度を振ったkinetics/affinity解析の際や複数のリガンドを評価する場合に有用です。核酸の相互作用に用いることはできません。 |
|
Sensor Chip CM5 | ニトリロ三酢酸(NTA)を固定化したタイプ。 | リガンドにHisタグタンパク質を用いる場合に利用されます。 |
|
Sensor Chip CM5 | MabSelect SuRe™ と同じProtein Aを固定化したタイプ。 | 哺乳動物由来抗体用で、例えばhuman IgG1, IgG2, IgG4 のキャプチャーが可能です。human IgG3 には結合しません。 |
|
Sensor Chip CM5 | Protein Gを固定化したタイプ。 | 哺乳動物由来抗体用で、human、rat、mouse、rabbit、goat、cow 等のさまざまな哺乳動物由来の IgG のキャプチャーが可能です。chicken IgG および human IgA、IgD、IgE、IgM には結合しません。 |
|
Sensor Chip CM5 | Protein Lを固定化したタイプ。 | 哺乳動物由来抗体用で、ヒトまたはマウス由来の Fabs、single-chain variable fragments (scFv)、domain antibodies (dAbs) のキャプチャーが可能です。主に濃度定量や yes / no スクリーニングに使用されます。抗原結合に伴い、ベースラインドリフトが生じることがあるため、kinetics/affinity解析には用いられません。 |
|
Sensor Chip CM5 | MabSelect PrismA™と同じProtein Aを固定化したタイプ。 | モノクローナル抗体精製および抗体医薬品製造用rProtein A レジンMabSelect PrismA™ と同じProtein Aを固定化したタイプです。主にプロセス開発、品質管理における濃度定量用(詳細下記)に用いられます。VH3とも結合するため、kinetics解析などには用いられません。 |
|
金膜 | 金膜をC18(疎水基)でコーティングしたタイプ。 | 疎水吸着で主に単層膜を吸着する時に用いられますが、非常に疎水性が強いため、初めての検討でしたら下のSensor chip L1をお勧めします。 |
|
Sensor Chip CM5 | デキストラン基に長鎖アルカン(疎水基)を導入したタイプ。 | 親水性と疎水性の混在したセンサーチップで、二重膜やリポソームなどを吸着する時に用いられます。 |
|
金膜 | ベアな金膜 | SIA kit Auは組み立てて利用します。金膜のみを加工可能ですので、装置外でSAM膜を形成させたり、スパッタリングで単相膜を形成させることが可能です。 |
センサーチップの選択方法に関しましては、こちらのフローチャートをご参考にしてください。
How to choose a suitable attachment approach for your ligand各種センサーチップのアプリケーション事例
センサーチップは表1の通り、リガンドの分子種やアナライトの特性によって使い分けていただきます。ここでは実際にどのようなアプリケーションで使用されているのか紹介します。また、同じタグを持った分子でも複数のセンサーチップから選択が可能なケースがあります。それぞれのセンサーチップによる比較なども参考にして下さい。
- Hisタグタンパク質
・Sensor Chip NTA
・Sensor Chip CM5+His capture kitApproaches for capture of histidine-tagged proteins in Biacore™ systems
CY13375-12May20-ANHisタグタンパク質をキャプチャー法でセンサーチップ上に保持する場合、上記2つが提案できますが、それぞれのアプローチについて測定方法、得られる結果の違いや注意点を述べています。
Profiling inhibitor selectivity for PARP protein family members
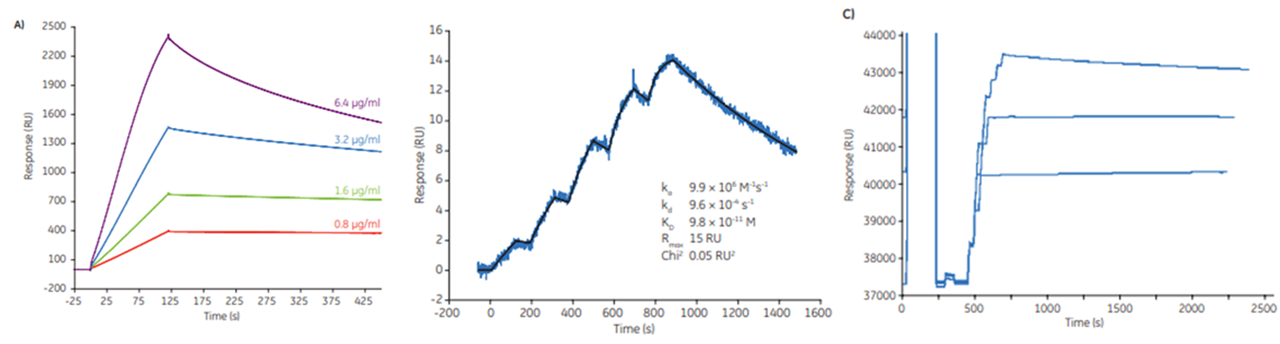
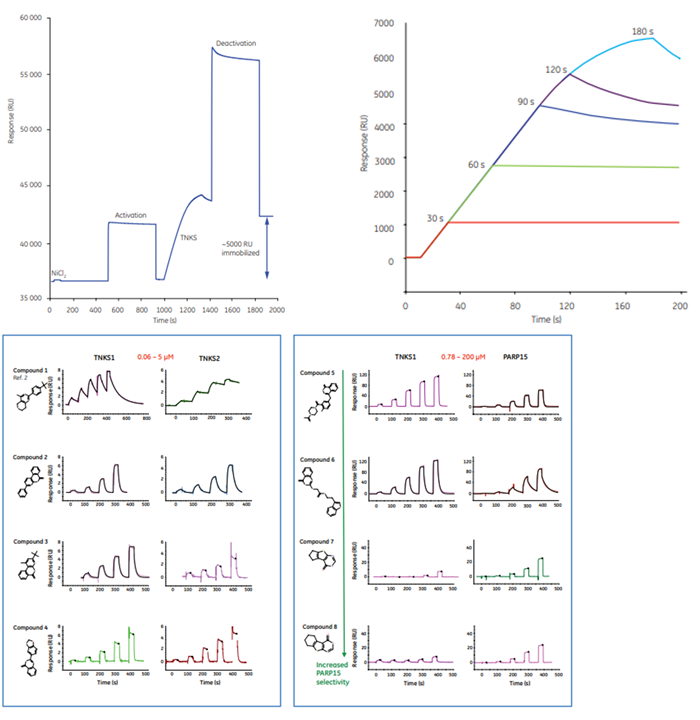
CY13362-12May20-ANヒトのポリADPリボースポリメラーゼ(PARP)ファミリーの阻害剤についてスクリーニング、プロファイリングを行った事例です。スクリーニングの段階ではHisタグ付きPARPに対し、NTAチップを用いたクロスリンク法で固定化しました。次にkineticsプロファイリングを行う際は同様にNTAチップを用いますがクロスリンク法は取らず、キャプチャー法でデータ取得しています。
- Biotin標識タンパク質
・Sensor Chip SA
・Sensor Chip NA
・Sensor Chip CAP(Biotin CAPture kit付属)Reversible capture of biotinylated molecules for Biacore™ analysis using Biotin CAPture kit
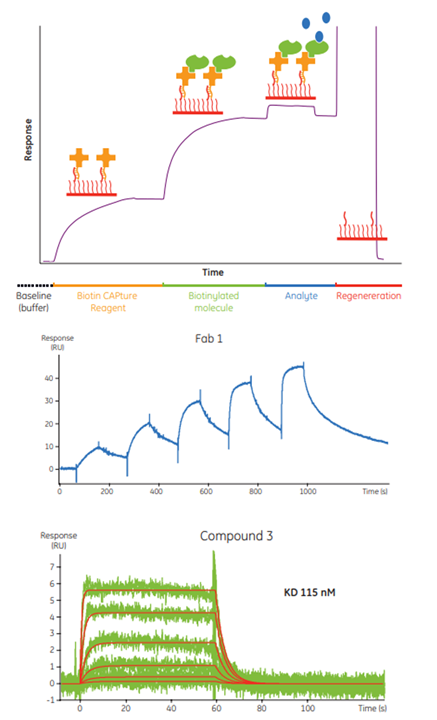
CY13541-19May20-PTセンサーチップ表面の再生が可能なBiotin CAPture kitを用いた複数の事例です。1) 三量体を形成し再生溶液による影響を受けやすいTNF-αとFabフラグメントの相互作用。2) 酸の影響を受けやすくアミンカップリングが難しいキナーゼと低分子化合物の相互作用。その他、繰り返し測定によるリガンドキャプチャーの安定性も評価しています。
リガンド分子のBiotin標識方法からBiotin CAPture Kitの使用方法に関しては、こちらのWebinarや資料もご覧ください。
Sensor Chip NA for high-performance Biacore™ SPR analysis
CY15073-11Sep20-POセンサーチップNAの特長、低分子化合物のアフィニティー測定事例、stickyなフラグメントにおけるClean Screenでの改善事例などが紹介されています。また、高pI(非Biotin化)タンパク質による非特異結合に関してSensor Chip NA/SA/CAPで比較しました。
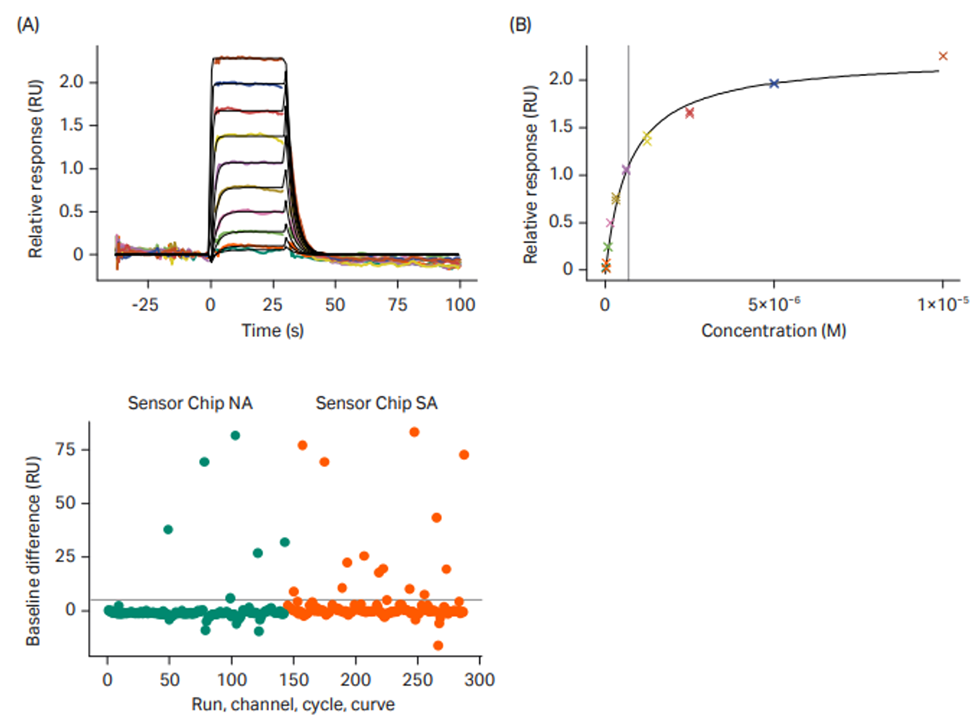
そのほか、Sensor Chip SAでは、様々な測定事例が報告されています。
- 抗体
・Sensor Chip Protein A, Sensor Chip Protein G, Sensor Chip Protein L, Sensor Chip PrismA
・Sensor Chip CM5 + 各種antibody capture kitBiacore™ concentration and ligand-binding analyses in late-stage development and quality control of biotherapeutics
CY13627-21May20-WP低分子医薬品と比べて構造が複雑で、複数の標的分子に高い特異性を持って結合するバイオ医薬品は、開発時や品質管理において構造的な完全性や活性を評価するために様々な分析技術が用いられています。こちらではBiacore™を用いた活性濃度測定、標的との結合、FcRの分析、およびこれらのアッセイを用いた医薬品のpotencyとstabilityの評価について解説しています。特にFcRの分析においては、Hisタグ付加FcRをキャプチャーする場合、抗体をProtein Aでキャプチャーする場合、2種類のフォーマットで測定を行っています。
こちらでは、Sensor chip PrismA、Protein A、Protein G、Protein L、Human antibody capture kit、Human Fab capture kit、Mouse antibody capture kitの使い分けについてまとめておりますのでご参考ください。
- 非特異結合の多いアナライト溶液
・Sensor Chip PEG
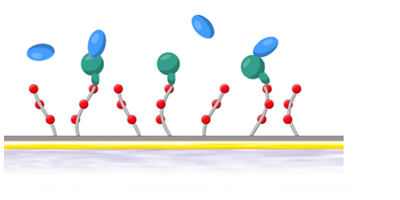
Sensor Chip CM3/4/5/7などデキストランマトリクスそのものに対する非特異結合が、ランニング緩衝液の検討、リファレンスセルのブロッキングなどで除けない場合、Sensor Chip PEGを用います。また、カルボキシル基はPEGの先端にのみ存在するため、フラットなセンサーチップ表面を形成し、多価分子や巨大な分子をアナライトとする際にも有効です。ただし、最大固定化容量はSensor Chip CM5の1/10程度(C1と同等)となります。
フィルトレーションおよび遠心分離を行ったヒト血漿をSensor Chip CM5、C1、PEG に60秒間コンタクトさせたところ、Sensor Chip PEGで最も非特異結合が低いことが確認されています(図2)。
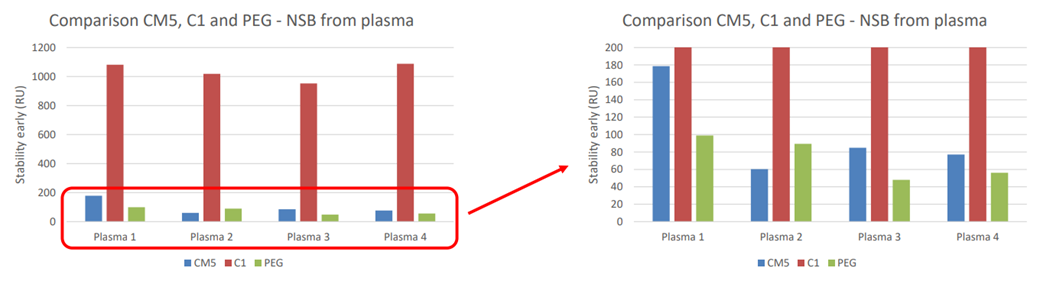
図 2:Sensor Chip CM5、C1、PEGのヒト血漿による非特異結合の影響
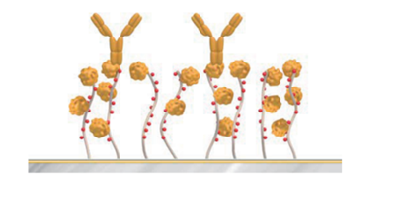
青:CM5、赤:C1、緑:PEG。右図はY軸のスケールを拡大したもの。2018年のDevelopments in Protein Interaction Analysis (DiPIA)では、Roche Diagnostics社より、Biacore™ 8KとSensor Chip PEG用いた、非常に結合の強いホモダイマーと抗体の相互作用を測定した事例が紹介されました。抗体をリガンド、ホモダイマーをアナライトとして、1:1bindingの系とする場合、極限まで固定化量を下げる必要があります。Rmax < 2.5 RUまで固定化量を下げて測定した結果、CM5でセンサーグラムの変形が見られたのに対し、PEGで改善できました(図3)。
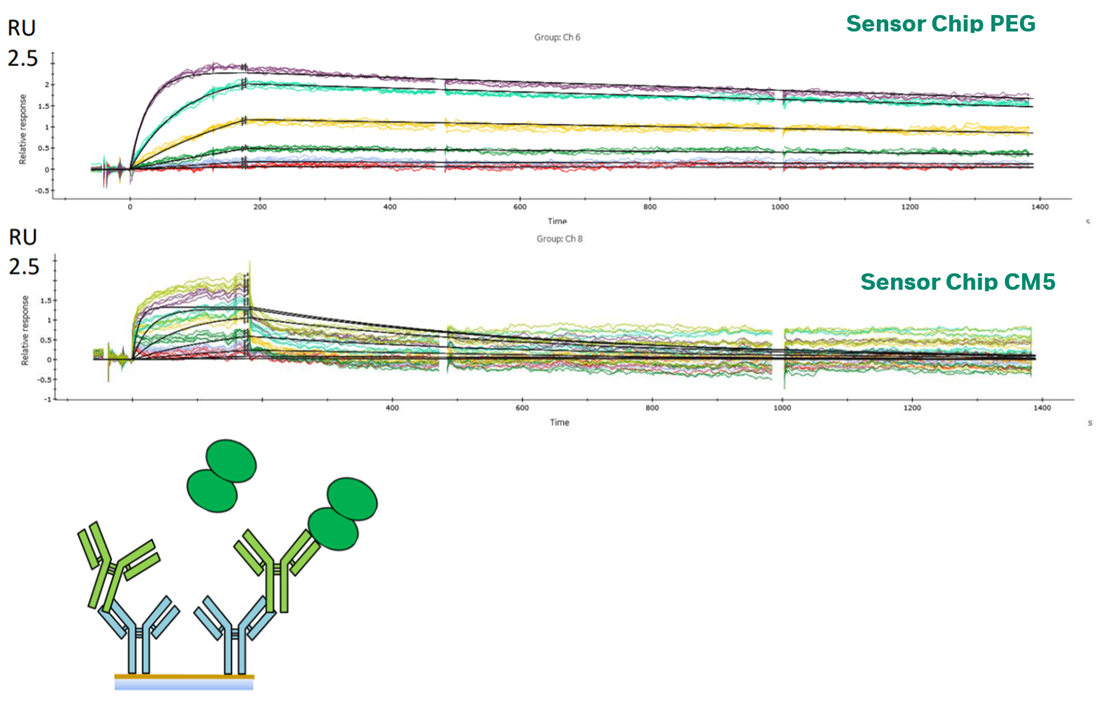
図 3:Avastin™(抗hVEGF-Aモノクローナル抗体)とhVEGF Aの相互作用試験
上段:Sensor Chip PEG、下段:Sensor Chip CM5。右図:測定の模式図、Sensor Chip PEG/CM5に対して、抗ヒトFc抗体を用いたキャプチャー法を用いています。
いかがでしょうか。Sensor Chipの種類が多いということは、それだけリガンドを保持するアプローチが多いということで、何らかの方法がうまくいかずとも、別の方法にて回避可能な可能性が高まります。実験が詰まった時にふとこれらの資料を思い返していただければ幸いです。