歴史的背景から学ぶMC法とSC法の違い
SC法はMC法の弱点を補うために生まれた
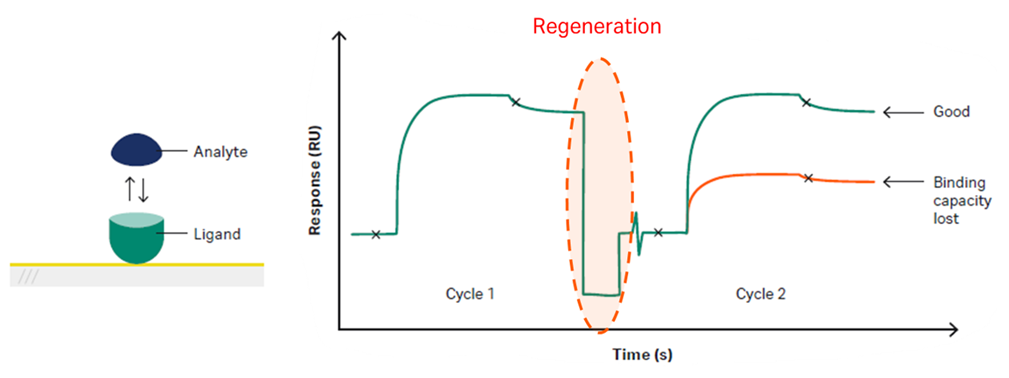
Figure 1:再生操作で結合活性を失うリガンドの例
リガンドが共有結合でセンサー表面に固定化されているとき、適切な再生条件を見出すことが困難な場合があることは古くから知られていました。そこでSchuck, P. et al (1998) Anal. Biochem. 265, 79-91.では閉ループで連続的にアナライトを循環させ段階的に濃度を上げていき、それぞれの濃度で平衡状態に達するまで接触させる平衡滴定の方法を編み出したり(Hall, D.R., and Winzor, D.J. (1997) Anal. Biochem. 244, 152-160. また、Myszka, D. G. et al. (1998) Anal. Biochem. 265, 326-330ではアナライトを直接ランニング緩衝液に入れることで同様の段階的平衡滴定手順を踏んでいる)、Shank-Retzlaff, M. L., and Sligar, S. G. (2000) Anal. Chem. 72, 42 12-4220ではアナライトの濃度が時間に対して直線的に増加するように勾配を付けて添加するワンステップの方法を記載しています。あるいは米国特許US-A1-2003/014365では、キュベットを用いてアナライトの濃度を毎回段階的に変更しながら、各アナライト濃度に対する結合曲線部分を別々にフィッティングして、それぞれの初期結合速度を決定する方法を提示しています。
速度論的パラメータを決定するためのマルチプル滴定の利用については、当時は上述のShank Retzlaff, M. L., and Sligar, S. G. (2000), およびUS-A1-2003/ 014365にのみ開示されていると思われます。それでも前者はアナライトの連続勾配を使用しなければならないという制限があり、後者はマストランスポートリミテーションにより初期結合速度が本来の結合速度よりも小さいことが多く、解析値の信頼性に欠けるという課題がありました。
このような背景から生まれたのがSingle Cycle法だったというわけです。SC法ではセンサー表面の再生を行わずにアナライト濃度を段階的に変化して測定し、マストランスポートリミテーションの考慮されたkinetics modelに関して、検出されたセンサーグラム全体の解析を実施してパラメータを算出します。この背景などは米国特許US-9,316,636 B2に記載されており、解析の詳細についてはAnalytical Biochemistry 349 (2006) 136-147に記載されています。
Multi cycle法とSingle cycle法の違い
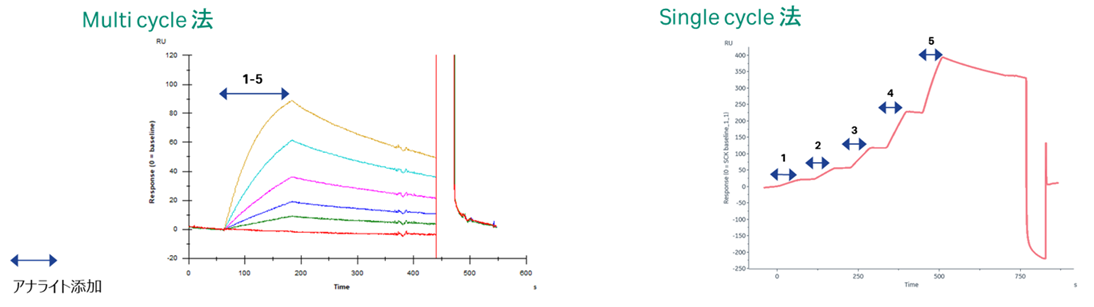
| Multi cycle法 各濃度は個別サイクルで測定する |
Single cycle法 各濃度は同一サイクルで測定する |
|
|---|---|---|
| Pros |
|
|
| Cons |
|
|
Figure 2
アナライトが全て解離していない状態で次の濃度のアナライトを添加して良いの?
MC法ではアナライトを全て解離させた状態で次の濃度のアナライトを添加します。一方でSC法ではアナライトが解離しきっていない状態で次の濃度のアナライトを添加してしまいます。なぜこんなことをしても良いのでしょうか。詳細な式はAnalytical Biochemistry 349 (2006) 136-147に記載されておりますのでご参考いただくとして、端的に申し上げればトータルレスポンスに対してそれまでに添加したアナライトで積み上げられたレスポンス分が反映されているためです。1:1 binding modelの微分方程式自体はMC法とSC法で違いはありません。
数学的な計算式については後述の補足情報でご確認いただくとして、まずは全体のイメージを掴んでみたいと思います。
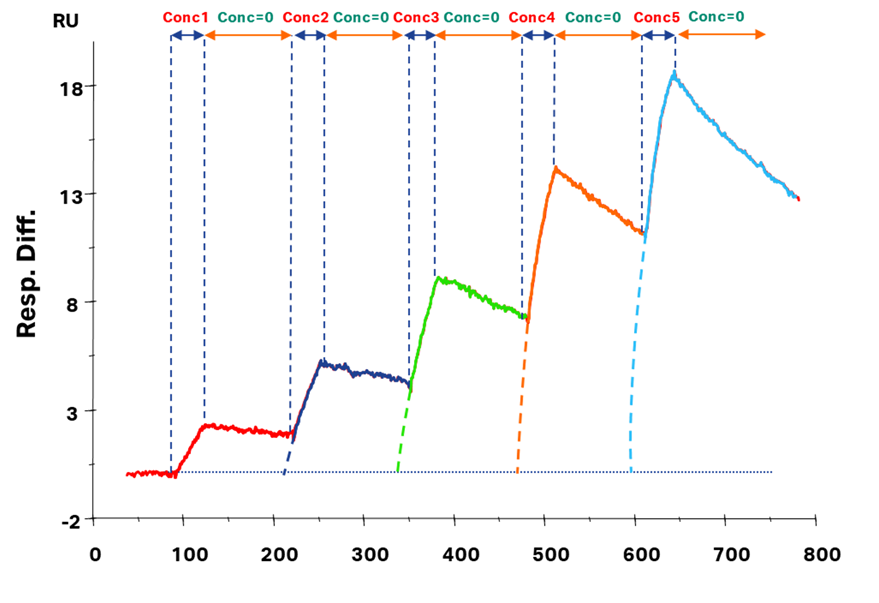
Figure 3
用いるモデル式の微分方程式が同じものを利用しているのであれば、得られるセンサーグラムが同じなら同じ解析結果が得られるわけです。さてここでSC法で得られるセンサーグラムについて誰しもが思う疑問は、「一つ手前のアナライト添加により、ある程度フリーなリガンドが占有されている状態からアナライトを添加した場合と、完全にフリーなリガンドしかない状態からアナライトを添加した場合とで、得られるセンサーグラムの形状は同じなのか?」なのではないでしょうか。
ちょっと状況整理のためにFigure 3を見てみましょう。この図では赤、青、緑、橙、水色…とアナライトが次々に添加されています。便宜上、それぞれをA1, A2, A3, A4, A5とおき、その濃度を順番にConc1, Conc2, Conc3, Conc4, Conc5とおいてみます。またその濃度は次のアナライトの濃度の方が必ず濃く、Conc(n-1) < Conc(n)と仮定しましょう。
ではA1が添加された場面から順に想像してみます。A1が結合相においてConc1の濃度で添加されました。A1はリガンドと結合し複合体を形成するのと同時に、形成された複合体が解離もしています。続いて解離相においてはアナライトの注入がストップし、ランニング緩衝液が流れ(Conc=0となります)、このときはひたすら複合体が解離していく状況です。また、結合相と解離相で複合体の解離速度定数は同じです。さて、A2が添加される直前にはまだ複合体が存在しており、僅かずつ解離している状況です。ここで濃度Conc2のA2が添加されました。
A2の目線になってみると、幾分か複合体を形成しているものが見えます。しかし、この状況は完全にフリーなリガンドしかない状態からA2を添加して少し経過した状況と同じであることがお分かりいただけますでしょうか。つまり、ゼロからA2を添加した場合のセンサーグラムの序盤だけスキップしたようなセンサーグラム(=Figure 3における破線で示された領域が欠けたセンサーグラム)が描けるはずなのです。
ここに多くの方が陥る勘違いがあったのではないでしょうか。つまり、SC法のA(n)の添加におけるベースラインは、あくまでA1添加前のまっさらなベースラインが基準であり、A(n-1)の添加で得られたレスポンスではない、ということです。考えてみれば、ある濃度で添加されたアナライトは必ずその濃度における平衡値までしか結合しないわけです。もしA(n-1)の添加で上がったレスポンスをベースラインとして考えてしまったら、A(n)の添加でConc(n)の平衡値を飛び越えてしまいそうなことが感覚的にご理解いただけるのではないでしょうか。
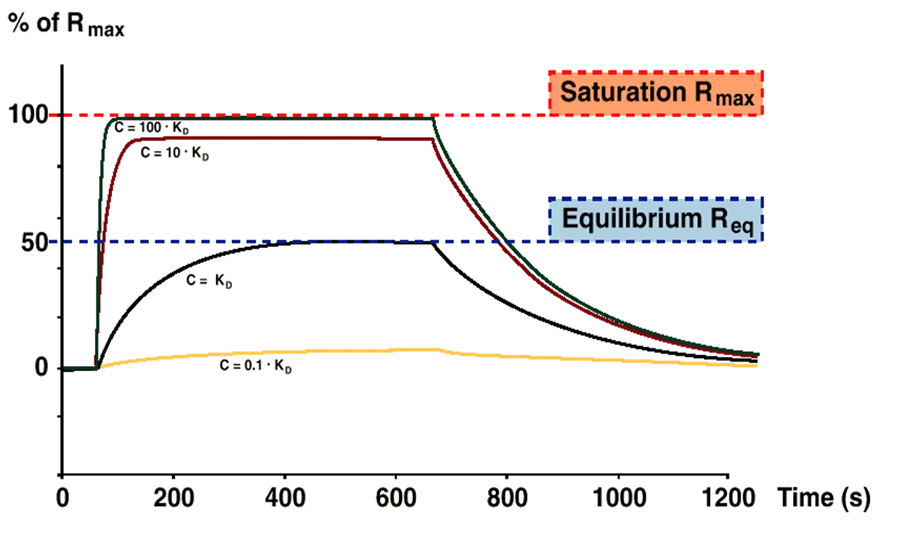
Figure 4:平衡値(Req)。C=KDの添加で25%Rmaxまで到達した後、再度C=KDの添加をしても75%Rmax まで到達するわけではない。
SC法の適切な濃度範囲は?
SC法はセンサーグラム形状が同じですのでMC法と全く同じ濃度帯を利用すれば良いです。すなわち、
- 最高濃度においては結合相でRmaxに近いレスポンスの平衡状態が見られることが望ましい
- 測定濃度条件はなるべく広い範囲で多点で取ると良い(例えば5点程度あると良い解析になりやすい)
- KD値を挟むように広い濃度帯の条件を用意すると良い
となり、一般的には10~100 * KDから2~5倍希釈で5点分の濃度条件を振ると大体良い濃度条件になります。
添加時間は多くの場合で2分間も用意しておけば、こうした最高濃度のアナライトを添加した時に大体平衡状態に達するはずであり、10 * KDを添加していれば平衡状態に達した時に理論上90 %Rmaxが、100 * KDを添加していれば平衡状態に達した時に理論上99 % Rmaxが達成されるはずです。
SC法における解離相
Kinetics解析を行うに当たっては、より妥当な解析結果を得るためには5-10%程度以上は解離していた方が良く、解離時間は延ばすことが良くあります。ただし非常に解離が遅い相互作用もありますから、あまり5%などの数字に引っ張られ過ぎないでください。以下の表は参考です。
| kd (s-1) | Time for 10% dissociation |
|---|---|
| 10-2 | 0.2 min |
| 10-3 | 1.8 min |
| 10-4 | 17.6 min |
| 10-5 | 175.6 min |
結局MC法とSC法だったらどちらを使うのが良いの?
多くのケースでSC法をお勧めします。2つの理由と1つの注意点があります。
理由1:測定系全体にかかる時間が短くて済む
これはFigure 2をご覧いただくとすぐにご理解いただけると思います。左のMC法では1サイクル分にかかる時間こそ550s程度ですが、サイクル数は0濃度のデータも含めて8サイクルくらいかかりますので4400s(=73min)程度の時間が必要です。右のSC法では1サイクルは800s程度ですが、サイクル数は0濃度のデータも含め2サイクルですから1600s(=26min)程度の時間となり、かなり違いがあることがお分かりいただけると思います。他にも気付きにくいメリットとして、測定時間が短いことは各サンプルの経時変化の影響を受けにくいことも挙げられます。
【解析上の補足】
センサーグラムのフィッティングは実測値に対しモデル式上の各パラメータに様々な値を代入し続け、最終的にフィッティングカーブが可能な限り実測値に近付くものを採用します。この原則上、フィッティングカーブは全体のレスポンスが大きいセンサーグラムに引きずられやすい性質を持っています。言い方を変えれば、低濃度側のセンサーグラムは多少ブレようが、フィッティングには大して影響を及ぼさないということです。それでも低濃度のデータも取得するのは、高濃度のデータだけで解析するとすぐにセンサーグラムが平衡状態になってしまい、正確なkaの算出に影響があるためです。
理由2:特にBiotin CAPture Kitを使用時にBiotin CAPture Reagentの消費量が少なくて済む
汎用性の高いBiotin CAPture Kitを利用するにあたっては、はじめにBiotin CAPture Reagent、続いてビオチン標識リガンド、続いてアナライトを添加した後、再生して全てを解離させ、次のサイクルでは再びBiotin CAPture Reagentを添加します。すなわち、少ないサイクルで測定できるSC法の方が試薬を節約できるわけです。Figure 3はMC法での運用ですが、異なる濃度のAnalyteを添加したいなら毎回Biotin CAPture Reagentが必要なことがお分かりいただけると思います。
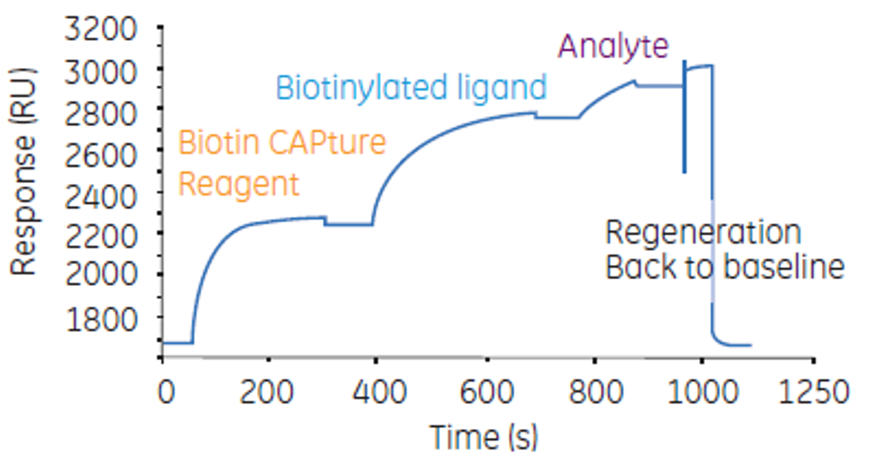
Figure 5
一方で注意点もあります。
注意点:キャプチャー法とSC法を組み合わせる場合はベースラインの安定性が重要
特にHisタグ付きリガンドをSensor Chip NTAとNTA Reagent Kitの組合せでキャプチャーしたり、Sensor Chip CM5とHis Capture Kitの組合せでキャプチャーする際に問題となります。Hisタグ付きリガンドをNiやHis抗体でキャプチャーする方法はあまり親和力が強くないため、たくさんキャプチャーさせても解離してしまいます(参考:Approaches for capture of histidine-tagged proteins in Biacore systems)。Hisタグ付きリガンドが解離している状況でアナライトとの相互作用を測定するのは、感覚的にもあまり良いデータが取れそうにないことがお分かりいただけると思います。MC法でもベースラインが不安定な状態でkinetics解析を実施するのは良くないのですが、1サイクルにかかる時間自体はSC法よりも短いため、解析への影響をSC法よりは低く抑えることが可能です。
こうして考えると、一度結合したリガンドはできるだけ安定にチップ表面に保持されていた方が良く、であればBiotin CAPture Kitがお勧めできる理由につながってくることもご理解いただけるのではないでしょうか。
まとめ
- SC法は、元々はMC法の弱点(再生できないサンプル)に対応する手段として生まれました。
- SC法はMC法と同じセンサーグラムが描けます。決して「MC法の簡便な代替法」ではありません。
- 試薬を節約できること、更に測定時間自体も短くなることなどから、むしろ現在の主流はSC法です。
- SC法とBiotin CAPture Kitの組合せは非常に汎用性が高く有用です。
以上、SC法について解説してまいりました。ぜひ積極的にSC法をご利用いただければと思います。
補足
現行のマストランスポートリミテーションを考慮した1:1 binding modelの微分方程式は以下のように記述されています。
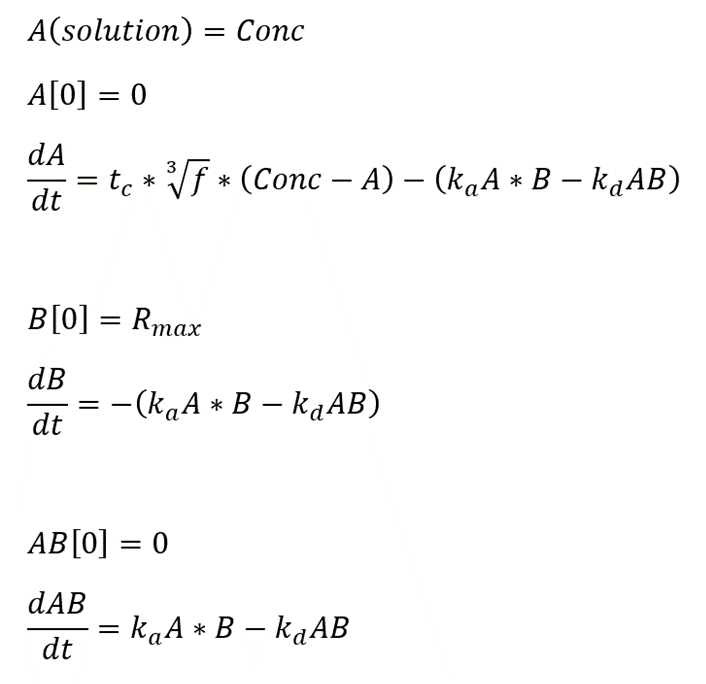
Aはチップ表面近傍におけるアナライト濃度、Bはフリーなリガンド濃度を指します。A(solution)はバイアルなどに用意したアナライトの濃度を指します。
フローセルに添加されたアナライト分子は、移動層を一定流速で流れながら、非撹拌層に向かって拡散します。更に、非撹拌層内を拡散して、リガンド分子に到達して相互作用します。このような、アナライト分子の「移動層から非撹拌層への輸送」をマストランスポートと呼びます。端的に申し上げれば用意したアナライトの濃度(Conc)は実際にリガンドと相互作用する時のチップ表面のアナライト濃度(A)とは少し違うということです。これは今回の主旨とは離れますのでこれくらいにしておきます(参考:マストランスポートリミテーションを式から理解する)。
ここで、MC法ではTotal responseは以下のようにAB(複合体)の形成レスポンスとRI(溶液効果)の和です。
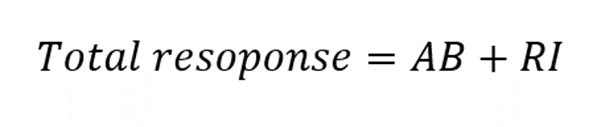
一方SC法ではABの形成レスポンスと各濃度のアナライトを注入ごとに蓄積されたRIの和となります($1~5は更に詳細な式と説明がpaper中に記載されておりますのでご参考ください。端的には、濃度の時間依存性を示しています)。
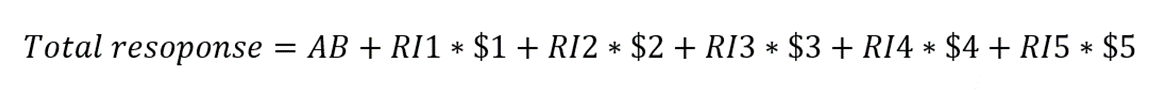
このTotal responseの計算上の違いにより、レスポンスがゼロにならなくともMC法と変わらない解析ができているというわけです。