突然ですが、弱い相互作用を測るのは難しいけれど強い相互作用を測るのは簡単なはずだよね!と思っている方いませんか?
実はこれ、正しくありません。確かに強い結合を“検出”するのは簡単なことが多いです。しかし、強い相互作用は多くの場合解離速度が遅くなりますが、その時に正確なka、kd、KDを出すのはいつも以上に気をつけなければいけないのです。
この記事では、測定する相互作用プロファイル(ka、kd、KDなど)によって、実験上どうしても生じる生データ(センサーグラム形状)の誤差、精度がフィッティング計算後の解析値としてのka、kd、KDの誤差、精度に与える影響が遅い解離の相互作用については大きくなる、ということです。いきなり“???”かもしれませんので、順を追ってご説明いたします。
まず“誤差”という言葉について確認したいと思います。
ここでいう誤差とは
誤差 = 測定値(あるいは解析値)- 真値
ですので、真度(accuracy)に関連する言葉として用います。
よく実験上出てくる言葉で標準“誤差”(S.E.)という言葉があり、実際Biacore™のka、kd、KDの解析結果はS.E.の値が併記され、“目安”としてS.E.の値が解の値の10%以下だったら、信頼してもいいのではないか?というやり取りがあったりもします。このあたりが少々ややこしいのですが、S.E.は真度ではなく精度(precision)に関連する数値です。(Fig 1)
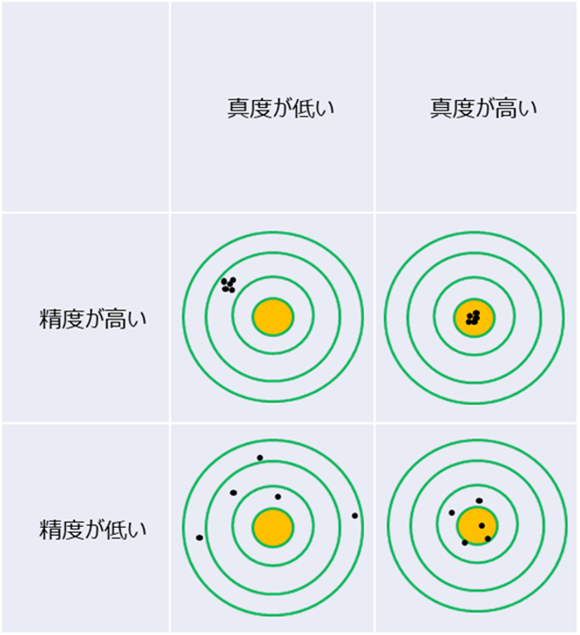
Fig.1:真度と精度の違い
この記事ではBiacore™の生データと解析値の誤差、精度をどう見積もるか?ということについて、(解析ソフトウエア上の様々な数値やdata QCシグナル以外の)”勘所”の一つについてのお話になります。
誤差、精度が小さいka、kd、KDを求めるためには、まずセンサーグラム形状の誤差、精度が小さいことが重要です。
しかしその時、疑問に思うのが、「“真値”が分からない…というよりも、その真値を知りたくて測定しているのに…」ということかと思います。Biacore™の生データの誤差を見積もる場合、真値とは「センサーグラム形状は今自分が定数化したい、結合部位特異的相互作用を正しく反映した形状になっているか」ということに相当します。Biacore™コンシェルジュ 4月号の“Rmaxのトリセツ”でもご紹介したように得られたセンサーグラムが理論的Rmax以下で飽和することを確認することで、正しく測定目的である結合部位特異的相互作用を反映したものかどうかを確認することで真度の高いセンサーグラムを得られているかはある程度可能です。(Biacore™コンシェルジュバックナンバーご希望の方はTech-JP@cytiva.comまでご連絡ください。また、Cytiva Webinarの“Biacore™の測定系構築の勘所”も是非ご参照ください)。
またある程度Biacore™のセンサーグラムを見る“目”が肥えてきたかたは、センサーグラム形状が少し歪んでるな、とか二相性の形状だな、なども真度を見積もる参考情報になると思います。このようにセンサーグラム形状から、ある程度生データの誤差の見積もりが可能である、というのはBiacore™の大きな特徴です。 精度の面では例えば0濃度データ(Blank)やn=2で取得している濃度のセンサーグラムの再現性が高いかどうかで確認できます。(Biacore™コンシェルジュ 3月号の“5濃度+0濃度、n=2?”もご参考ください)
しかし、いくらこのように見積もっても実験である以上、一定の誤差やばらつき(精度)は生じます。
この生データ(センサーグラム形状)の誤差やばらつきがフィッティング計算後のka、kd、KDの誤差やばらつきにどのくらい影響するか、というのが今日の本題です。
Fig.2 をご覧ください。Kd=10-3の解離速度の相互作用と10-5の相互作用を解析した場合、センサーグラム形状上の実験誤差・精度がRU単位として同じだったとして、解析結果のkd値に与える影響はどうなるでしょうか。例えば図の約630秒時点での、誤差あるいは精度が5RU真値からずれていたとしましょう。10-3の場合は一桁kdがずれることはないですが、10-5の場合は1桁どころかそれ以上ずれる可能性があることが分かると思います。そしてkdが例えば一桁ずれる、ということはKDも一桁ずれるということを意味します。
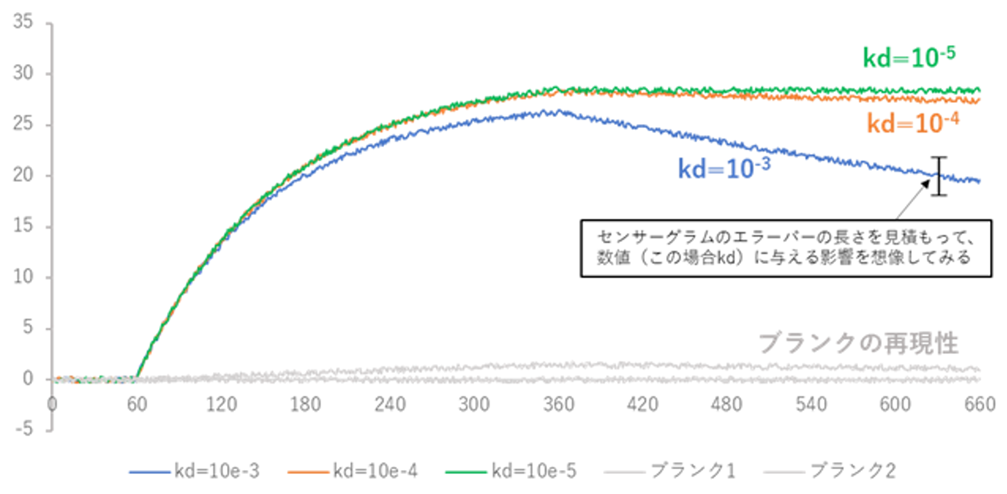
Fig.2:解離の遅い相互作用のkd解析結果に対して生データの誤差、精度が及ぼす影響の違い
いかがでしょうか。冒頭で言った強い相互作用(解離が遅い相互作用)を測定するときは気を付けなければいけないということが伝わりましたでしょうか。
では、このような解離の遅い相互作用を測定するときどのような測定条件にするとより良いのか
ということをお話したいと思います。まず、Fig.2の場合などは解離時間300secの間に10-5と10-4の間の差は1RU程度しかありません。ですのでこれをもう少し大きくした方が良い、ということになります。大きくするためには、以下の条件が考えられます。
- 固定化量をあげてレスポンス自体を大きくする。
- 解離時間(dissociation time)を長く設定する。
- シングルサイクルカイネティクス法を用いる。
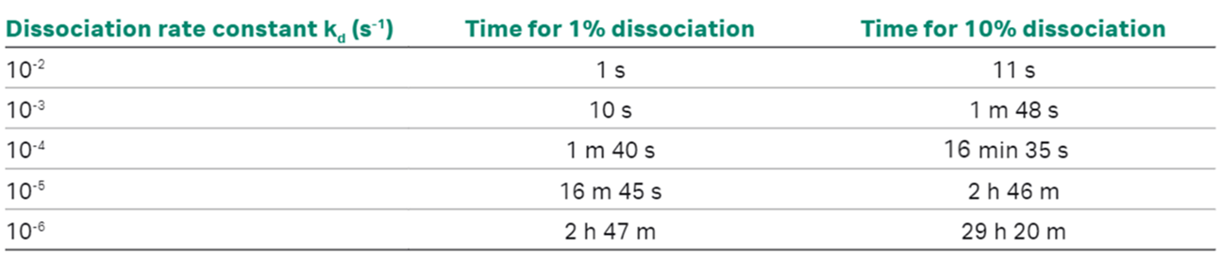
①の固定化量を上げるのはマストランスポートリミテーションの影響を大きくするリスクがありますので、上げすぎも良くありません。②に関しては、おおよその目安として10%程度は解離が観察されるような解離時間(Table 1)を設定するのが良いです。ただし10%はあくまで目安であり、ブランクやn=2で設定した濃度のセンサーグラムの再現性や、研究上許容できる誤差、精度によって変更可能なもので、絶対ではありません。
Table.1:kdと解離時間
③のシングルサイクルカイネティクス利用する理由は、解離領域のFitting計算範囲のほとんどをより解離量の大きい最高濃度のデータにすることができるからです。これによりマルチサイクルカイネティクスで低濃度側でほとんど解離が見られないような無意味なデータ領域に対しても測定、解析をする時間、誤差へのリスクを軽減することができます(Fig.3)
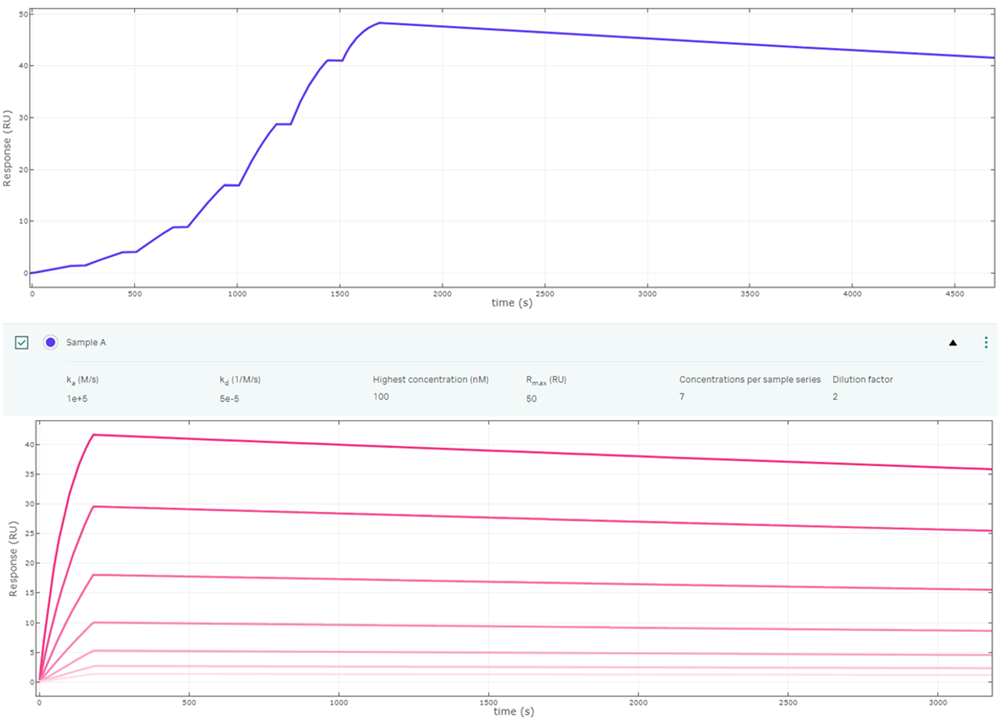
Fig.3:ka=05, kd=5×10-5 の相互作用のシングルサイクルカイネティクスとマルチサイクルカイネティクス
違った側面で注意する点を挙げると、装置自体の感度、再現性、再現性に結びつく装置コンディション(洗浄など)も留意事項になります。よくタンパク質間相互作用だったら感度が低くても良い、という話があったりするのですが、このように解離が遅い相互作用の場合などは、非常に小さいレスポンスの“下降量”を測定しないといけませんので検出感度(ノイズの小ささ)も大切になってきます。
このように考えていきますと、本当に実際上必要な精度・真度の高い解析値(ka, kd, KD)に対する感度(LOQ, 定量下限値)とは、本来装置検出器のもつ感度(ノイズの小ささ)と再現性と、個別の測定系で構築した誤差、精度等の総合的な要因で決定すると言えるのかもしれません。