バイオダイレクトメール vol.31 Technical Tips
<組換えタンパク質精製をはじめよう>Part 3
vol.29より3回シリーズでアフィニティークロマトグラフィーによる組換えタンパク質精製の基礎講座をお送りしています。Part3の今回は、組換えタンパク質として広く利用されているHis-tagタンパク質の精製についてご紹介します。
His-tagタンパク質とは
His-tagタンパク質(Histidine tagged Protein)は、アフィニティー精製のためにヒスチジン6~10残基を含む短いペプチドを末端*に付加したタンパク質です。ヒスチジンのイミダゾール環にはニッケルやコバルトイオンと強く結合する性質があるため、His-tagタンパク質はこれらの金属イオンを結合したクロマトグラフィー担体を用いて容易に回収・精製することができます。さまざまな発現ベクターが市販されているためプラスミド構築も容易であり、組換えタンパク質の発現・精製法として広く活用されています。
*アミノ末端・カルボキシル末端のいずれかに付加するのが一般的ですが、両端に付加する場合もあります。
His-tagタンパク質の特徴
His-tagタンパク質の特徴は、His-tag部分の配列が単純で分子量が小さい点にあります。このため、(1)目的タンパク質の立体構造への影響が少ない(2)His-tag部分の立体構造に変化がないため、アフィニティー精製時に変性剤を加えても回収効率への影響が小さい(3)タグ部分は免疫原性をほとんど示さないなどといった利点があります。ただし、タンパク質の種類や実験の目的によっては、His-tag部分が予想外の影響をおよぼすことがあります。その場合はプロテアーゼ認識部位を組み込んで、精製後にHis-tag部分を目的タンパク質から除去できるようにするなどの工夫が必要です。
His-tagタンパク質の精製
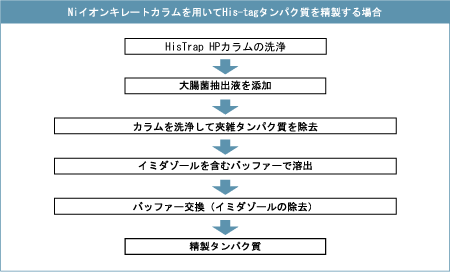
発現したHis-tagタンパク質は、ニッケルイオンを配位結合した金属キレートアフィニティーカラムを利用して高純度に精製することができます。カラムに結合させた後、イミダゾールを添加するとHis-tagのヒスチジン残基のイミダゾール環と拮抗的に作用して、His-tagがニッケルイオンから解離し、His-tagタンパク質がカラムから溶出されます。
実際の操作は以下に示す流れにしたがって行います。バッチ法でサンプルの清澄化ステップを省略することも可能です。
溶出条件の至適化
標準的なプロトコールによる精製では、高濃度のイミダゾールを用いてワンステップでHis-tagタンパク質を溶出しますが、それで十分な純度が得られない場合は、ステップワイズもしくはグラジエント溶出の予備実験によって最適なイミダゾール濃度を調べます。なお、大腸菌由来タンパク質の混入は、サンプルの添加時に用いる結合バッファーに低濃度(20~40 mM)のイミダゾールを添加することで防ぐことができます。
関連情報

