バイオ医薬品の連続生産
いかに最適なバイオプロセス戦略を構築するか?
本記事は、Genetic Engineering & Biotechnology News 2017年9月15日(Vol. 37、No. 16)を日本語訳しております。
元の 記事はこちらからご覧いただけます
世界の売上高ベースで上位10社のうち8社を占める製薬企業によると、バイオ医薬品は年平均成長率(CAGR)9%で成長しており、2022年までに売上高は3260億ドルに到達すると予測されています1。ますます競争が激化する状況のなかで、バイオ医薬品業界は「生産性の改善」、「効率化」、「臨床や市場に到達するまでのスピードアップ」の必要性に直面しています。そのため、最近では「革新的な製造ソリューション」に注目が集まっています2。
有望なアプローチのひとつは、「連続生産」です。プロセス中に分解を起こしやすいバイオ医薬品ではこの方法は数十年前から使用されており、他の業界でも広く用いられています。調査会社Bioplan Associatesがバイオ医薬品業界を対象として最近実施した調査では、回答者の4分の3が連続生産(CB)の評価または検討を行っていると答えました。また約3分の1が、サプライヤーが開発に力をいれるべきトップ分野として「ダウンストリームの連続生産」を挙げています3。
バイオ医薬品業界が「連続生産」に関心を高めているのは、「コスト削減」「品質改善」および「生産性向上」が期待されるためです。
他の業界では、売上原価(COGS)およびプロセスエコノミーを改善するために連続処理が使用されています。しかし、これまでに発表されているプロセスエコノミーモデルを用いた解析では、バイオ医薬品の連続生産に関して結果は一貫していないことが示されています(表 1)。原薬(API)の量や製造戦略によって、また設備投資額(CAPEX)またはCOGS、またはその双方が最優先事項だったか、それによって結果が左右されます4。
バッチプロセスおよびフェドバッチ(FB)プロセス中に分解を起こしやすいバイオ医薬品については、連続生産によって安定した状態で処理することが可能になります。一方、比較的安定なモノクローナル抗体(mAb)などについても、品質上の利点が得られる可能性があります。バッチプロセスまたはFBプロセスの中でmAbのグリコシル化プロファイルが変化する可能性がありますが、これはおそらく分泌後の酵素的修飾または分解によるものと思われます5。グリコシル化プロファイルが安全性または有効性に重要である分子の場合、連続生産は有益な方法になると考えられます。
バイオ医薬品企業は、単位稼働あたりの生産性または年間処理能力(kg/yr)を増大させること、特にアップストリームとダウンストリームの両者に影響する、低発現細胞株の生産性増大を強く求められています。さらに、同じ施設内で複数の製品を生産しなければならないため、高い生産性が求められています。生産性(g/hrまたはkg/yr)を最大化し運転コストを低減させるには、機器の「高い稼働率」が鍵となります。連続モードで運転している場合、その操作の間は、機器の稼働率は計算上100%となります5。
ダウンストリームでは、課題は製造規模によって異なります。臨床規模ではクロマトグラフィー用レジンのコスト低減が主な焦点となりますが、これは一般にレジンを寿命一杯使用することができないためです。商業規模の製造ではレジンの寿命活用率は比較的高いため、主な課題は設備稼働率と生産率の両方を最大化することです。

表1.プロセスエコノミーモデル:バイオ医薬品におけるバッチ、ハイブリッド、そして連続生産の分析
ここでは、3つの規模のモノクローナル抗体プロセスをモデル化しており、製造工程で一般的に見られる範囲を表しています。モデル化は、アップストリームの各モードに典型的なモノクローナル抗体の力価(FBで5 g/L、パーフュージョン法で1.2 g/L)に基づいています。BioPharm Services社からの許可を得て表1を使用しています。
バイオ医薬品の連続生産:製造戦略の比較
連続生産(Continuous Bioprocessing, 以下CB)には、一連の操作モードがあります。連続単位操作は、長時間にわたり連続フローがインプットされ、内部保留量を最小限とする操作です。連続プロセスは、各操作間の内部保留量を最小限に抑えながら、複数の連続単位操作が物理的につながったプロセスと定義できます5。連続プロセスは、完全な連続エンドツーエンドプロセスと部分連続(ハイブリッドまたは半連続)プロセスに分けられます。
従来、アップストリームCBはパーフュージョンモードで連続的に運転するステージNの生産バイオリアクターを操作することを指し、このプロセスはしばしば連続回収と併用されます。より目的を絞ったCB単位操作法の例としては、高密度細胞バンク構築のためのパーフュージョン培養やシード培養、N-1播種細胞調製が挙げられます。もうひとつは濃縮FBです。このプロセスによって、回収前にパーフュージョンシステムにより細胞または生成物を濃縮することで、連続操作の複雑さおよびリスクを回避します。
ダウンストリームCBは、しばしば連続クロマトグラフィーと呼ばれます。クロマトグラフィーベースのプロセスでは、周期的向流クロマトグラフィー(Periodic Counter-current chromatography, 以下PCC)または擬似移動床式分取クロマトグラフィー(Simulated Moving Bed, 以下SMB)と呼ばれる方法を用いて連続クロマトグラフィーを行うことができます。PCCでは、3本以上のカラムをローディングステップと非ローディングステップの間で切り替えて樹脂利用率を最大化し必要バッファー量を最小化します。ダウンストリームCBにつながる他の選択肢としては、同時バッファー調製(インライン・コンディショニング)および連続タンジェント流ろ過があります。
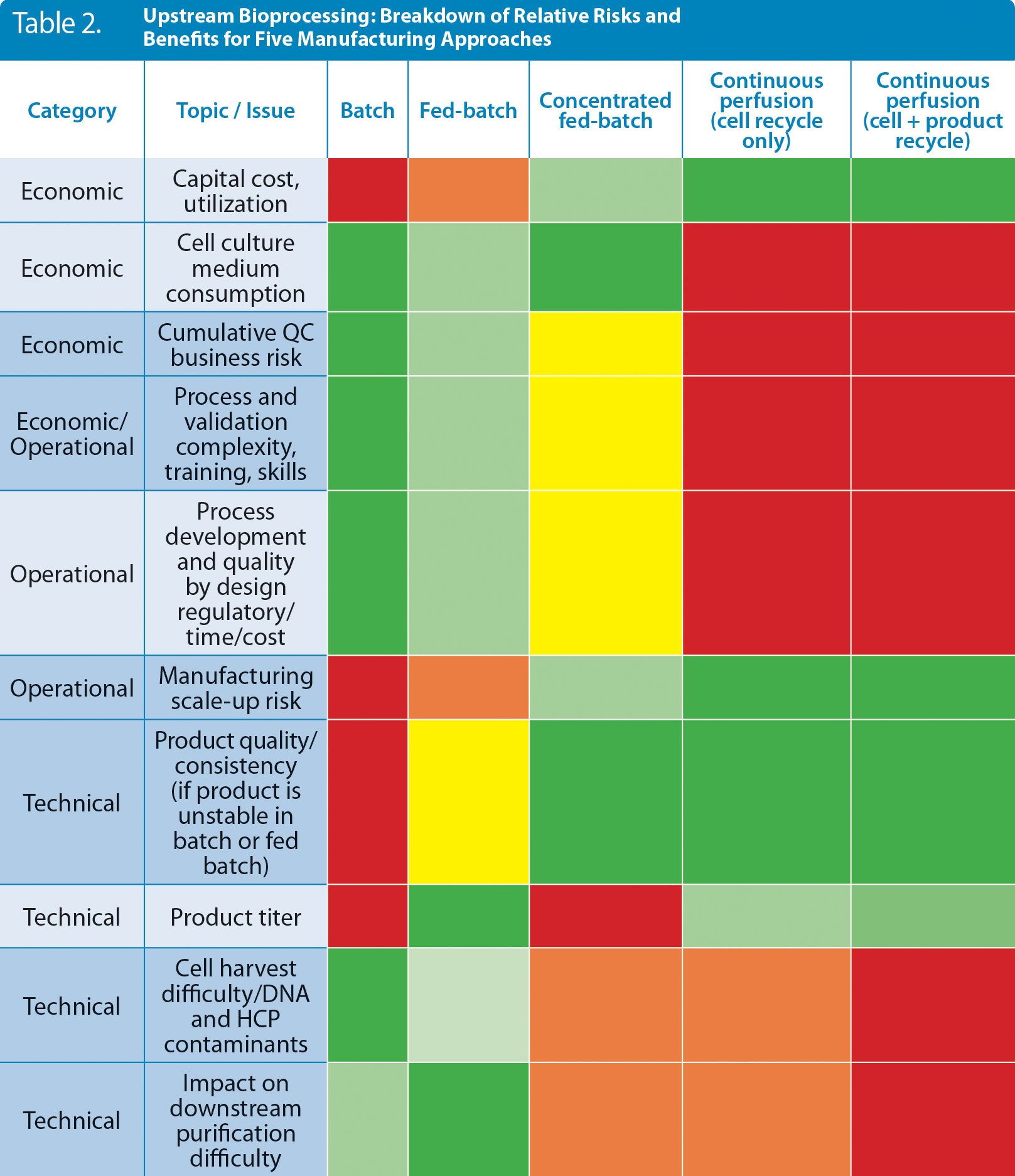
表2 アップストリーム工程:5つの製造アプローチに対するリスクと利点
「連続生産」に関する著者らの経験をもとに、「アップストリーム」におけるリスクとメリットをヒートマップ化した(赤:リスクが高い、緑:便益が最も大きい)。この表2も参考資料として、各企業において独自の評価を行っていただくことをお勧めします。メリットは応用分野(モノクローナル抗体、ワクチン、組換えタンパク質、血漿など)によって異なる可能性があることを考慮に入れることも重要です。
バッチ法、連続法など各製造アプローチには、それぞれ異なる長所・短所があります(表2)。たとえば、アップストリームCBでは、バッチ法およびFB法に比べてスケールアップがしやすく、資本コストが低減され、製品の品質が向上します。COGSに対する潜在的影響は非常に議論されており、多くの変数に左右されます4,6。しかし、アップストリームCBのこうした利点にはリスクもあります。たとえば、細胞培養培地の消費量およびコストの増大、さらにフィードバック/フィードフォワードプロセス制御のためにリアルタイムで検出する自動品質センサーや汚染センサーに何らかの理由で不備があった場合、多額の費用を費やして検証試験を行わなければならず、ビジネスリスク(累積的な品質管理リスク)が生じる可能性があります。その他のリスクとしては、細胞密度が飽和に達し処理が困難となる場合や、高濃度のDNAおよび宿主細胞タンパク質が混入してしまい高タイター化が難しくなるなど報告されています7。また、クオリティ・バイ・デザイン(QbD)プロセスの開発、検証およびトレーニングに対する負荷が高くなります。
同様に、ダウンストリームの製造アプローチにおいてもメリットとリスクがあり、それはトレードオフの関係となります(表3)。たとえば、連続プロセスは、特に治験薬製造のスケールにおいて一般にレジンの利用率および消費量に有利な影響を及ぼします。しかし、バッチプロセスと比較すると、連続プロセスではより複雑な機器が必要なため、資本コストへ影響します。また、プレパックカラムの多少の増加もしくはカラム充填を行う場合の作業増によるコストの増大は、上述したレジン利用率の改善によるコスト低減の一部を相殺してしまうケースもあります。
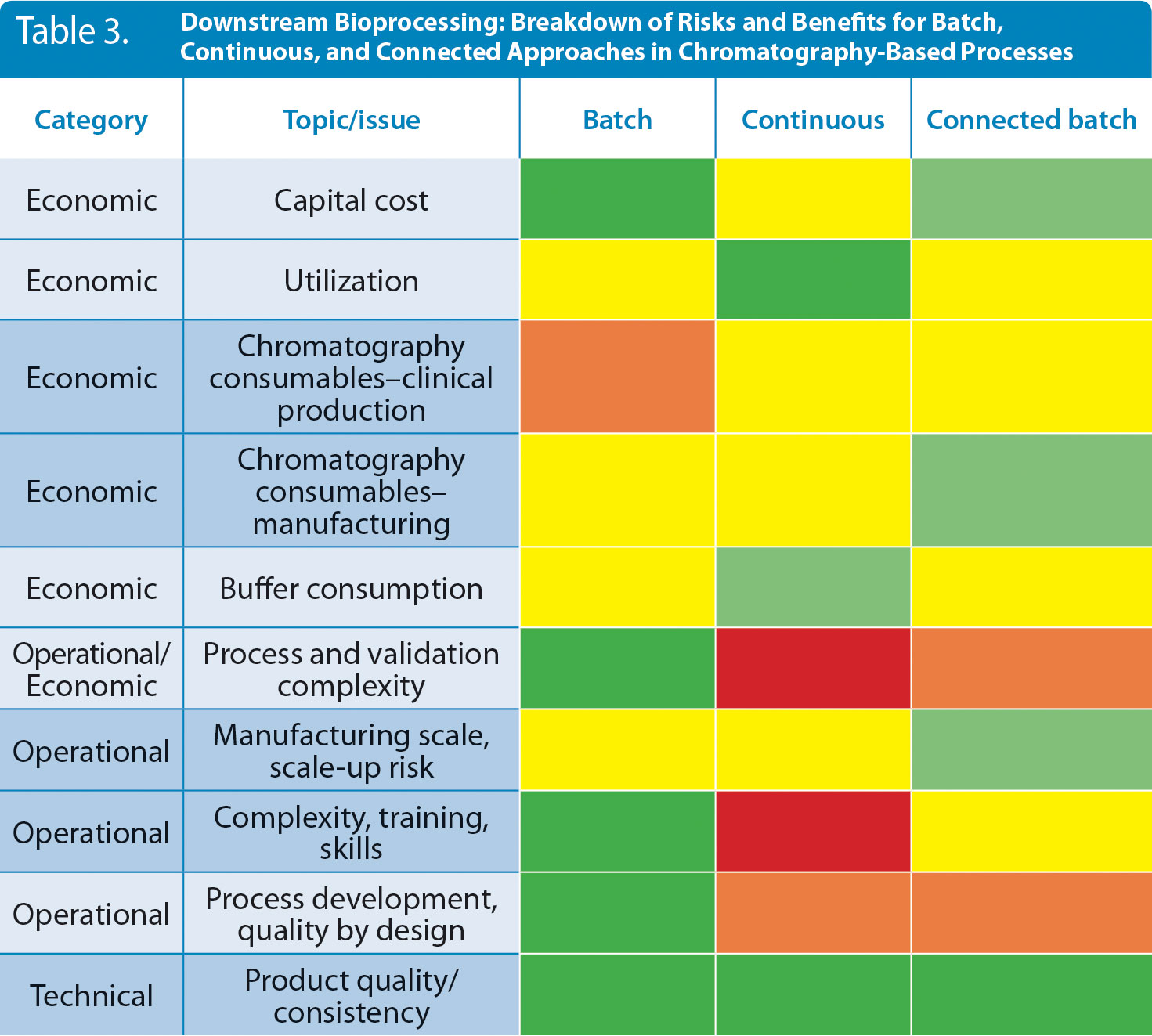
表3 ダウンストリーム工程:クロマトグラフィー工程におけるバッチ、連続モードのリスクと利点
「連続生産」に関する著者らの経験をもとに、「ダウンストリーム」におけるリスクとメリットをヒートマップ化した(赤:リスクが比較的高い、緑:メリットが最も大きい)。この表3も参考資料として、各企業において独自の評価を行っていただくことをお勧めします。メリットは応用分野(モノクローナル抗体、ワクチン、組換えタンパク質、血漿など)によって異なる可能性があることを考慮に入れることも重要です。
「連続化」導入の課題と機会
ある目的の連続単位操作は最小限のリスクで行えますが、エンドツーエンドCBを導入する際にはいくつかの課題に直面します。中心となる3つの問題は、「規制」「専門技術/複雑性」「制御戦略」です。
承認された約20種類のバイオ医薬品は、製造アップストリームでパーフュージョン法が使用されています。しかし、製造ダウンストリームで連続プロセスが採用されている承認事例は報告されていません。そのため、規制当局がダウンストリームにおける連続製造戦略を今後いかに承認するかについてはまだ不透明感が残っています。また、米国食品医薬品局(FDA)は新規テクノロジーの採用を促進するために「Emerging Technology Team」を発足させましたが、CBに関する経験を速やかに蓄積させる必要があり、CB向けのQbD試験の実施法についてガイダンスも必要です。
連続プロセスは複雑であるため、このプロセスの開発と運用には、傾向を把握して潜在的な逸脱を回避できる専門性が高いスタッフが必要であり、GMP製造への移行には専門的なオペレーターのトレーニングも必要です。計画外の生産停止および製品損失を軽減するため、故障モード管理計画も必要になります。また、制御およびバリデーションの対象となる連続単位操作の数が大幅に増えるため、QbDプロセスの開発および検証作業はさらに複雑になります。さらに、商業化段階では、高品質の原料を途切れることなく一貫して利用できるようにすることがきわめて重要です。
制御戦略に関する課題には、自動化およびPAT(process analytical technology)に関連するものが含まれます。リアルタイム検出のためのインラインセンサーおよびフィードバック/フィードフォワード制御が強く要望されていますが、その可能性は非常に制限されています。細胞培養培地、バッファーおよび他の原料の大量消費と相まって、このギャップが、エンドツーエンドの連続生産を検討しているバイオ医薬品メーカーにとって重大なビジネスリスクとなっています。適切な自動化を備えた制御戦略を構築することが、特にGMP製造環境において、連続化の運用を成功させるために必要不可欠です。
連続生産を支える「ソリューション」
状況によってはCBの利点がリスクを上回ることもありますが、すべてのバイオプロセスに一概に適用できるわけではありません。まずはGMP連続生産の専門家の助言をもらいながら、自社のプロセスについてニーズに基づいた分析を行うことを弊社から提案いたします。どのような状況において連続生産が製品の品質にプラスの影響を与え、プロセスの一貫性を向上させ、場合によってはコストを削減し、操作上の障害が取り除かれる可能性があるのか――このような分析により浮き彫りにすることができます。CBに意味のある事例としてよく挙げられるのは、バイオ医薬品の製品自体が不安定であるケース、そして細胞株の生産能力が低く生産性の改善が必要なケースです。
弊社は技術と製造に関する長年培ってきた専門知識によって、バイオ医薬品メーカーに対して「連続生産のための新しいアプローチ」をご提案しています。一例を挙げると、シングルユース(SU)ロッキング式細胞培養装置ReadyToProcess WAVE™ 25は、フェドバッチとパーフュージョンの両方のモードで高密度の細胞を生産することができるフレキシブルなツールです。ReadyToProcess WAVE™ 25は高密度細胞バンクを構築するシステムを兼ねることもできます。2000 Lのバイオリアクターに播種できる十分量のシード培養液を準備するために、ワンステッププロセスでこれらの高密度細胞バンクを使用できます8。SU XDRバイオリアクターは、連続パーフュージョン操作に採用されています9。ダウンストリームでは、リアルタイムプロセスモニタリング機能と動的制御機能を搭載した連続クロマトグラフィーシステムÄKTA pcc™が“ストレートスループロセッシング”へと接続され、自動でインラインコンディショニングテクノロジーを使用することから、プロセスがさらに強化されるという利便性をもたらします10。
参考文献
- EvaluatePharma™. World Preview 2017, Outlook to 2022. 10th Edition, June 2017.
- Deloitte, “Advanced Biopharmaceutical Manufacturing: An Evolution Underway,” (2015).
- BioPlan Associates, 14th Annual Report and Survey of Biopharmaceutical Manufacturing Capacity and Production, (2017).
- A. Sinclair, “Scale Up vs. Scale Out, What Drives the Decision,” BioPharm Services, presentation at Bioprocess International West (March 2017).
- K.B. Konstantinov and C.L. Clooney, “White Paper on Continuous Bioprocessing,” (May 20–21, 2014). Continuous Manufacturing Symposium, J. Pharm. Sci. 104, 813–820 (2015).
- J. Pollock, S.V. Ho, and S.S. Farid, “Fed-Batch and Perfusion Culture Processes: Economic, Environmental, and Operational Feasibility under Uncertainty,” Biotechnol. Bioeng. 110,206–219 (2013).
- B. Kelley, “Perspectives of Continuous Bioprocessing,” presentation at the CaSSS meeting (April 21, 2016).
- Cytiva, Application Note, “One-Step Seed Culture Expansion from One Vial of High-Density Cell Bank to 2000 L Production Bioreactor,” 29160932, Edition AB (2016).
- J. Stout, “Shire’s Manufacturing Strategy and New Flexible Facility: Completely Disposable Upstream and Traditional Stainless Downstream,” presentation from the IBC Life Sciences 7th International Biopharmaceutical Manufacturing and Development Summit (September 12–14, 2011).
- Cytiva, Application Note, “Continuous Chromatography in Downstream Processing of a Monoclonal Antibody,” 29170800 Edition AA (2015).
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。