はじめに
日々、Biacore™ をご利用している皆さまの研究室では、おおむねプロトコルが確立していることも多いかと思いますが、サンプルによってはトラブルに見舞われることもあるかもしれません。
そのような中でも代表的なトラブルであるセンサーチップ表面へのノンスぺに対抗する以下 2種のセンサーチップをご紹介します
- SensorChip PEG:低分子化合物以外、ノンスぺ以外にもavidity対策にも利用可能
- Series S SensorChip NA:低分子化合物用
こんなことありませんか?
非特異的結合が原因でうまく解析できない!
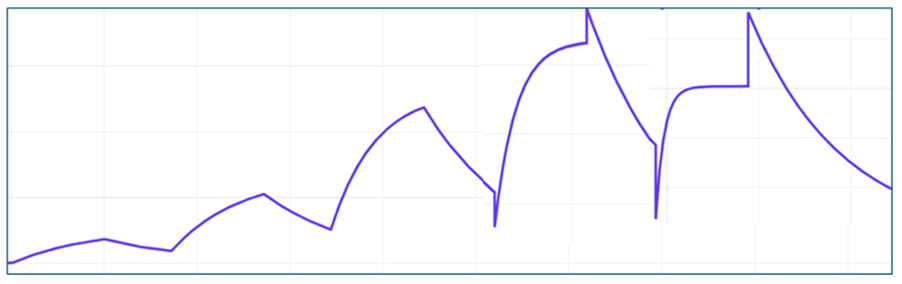
- 蛋白質-蛋白質の相互作用を見ていたら、例えば下図のようにリファレンスの差し引きがきれいにかからない。。。
- デキストランに結合特性を持つ可能性のあるアナライトを測りたい。。。
どうしても抗体や二量体をアナライトにしたい!
一般的に多価分子は固定化リガンド側にして、Avidityを回避した1:1の相互作用の測定環境を作ることが王道ですが、さまざまな理由で多価アナライトをアナライトにしたい場合は固定化量をきわめて少なくすることでリガンド間の立体的距離を長くし、1:1の測定環境を作る手法(参考資料 1)もあります。
ただ、SensorChip CM5は厚みを持ったデキストラン層に3Dでリガンドが固定化されるためか、きれいなセンサーグラム形状にならないこともあるようです。
アナライト化合物がセンサーチップに非特異的に結合してしまう。。。
標的タンパク質が塩基性でSensorChip SAに非特異的結合してしまう。。。
1. SensorChip PEGについて(Instructionはこちら)
センサーチップ構造概略
- カルボキシル化されたPEG
- 2D のフラット構造
期待される効果・アプリケーション
- 非特異的結合の軽減、解消
- Avidityを避けた測定環境を構築しやすい可能性がある
注意点
- 固定化キャパシティがSensorChip CM5に比べておおよそ10%
- 低分子化合物の相互作用測定の検証はCytivaでなされていない
- センサーチップの取り扱いやカップリング条件がSensorChip CM5と大きく異なる
など
ユーザー様のケーススタディ(二量体アナライトの測定)
抗体医薬品Avastinをキャプチャー法で固定化後、二量体抗原VEGFを添加した。SensorChip CM5 (Rmax 2.5RU程度)とSensorChip PEG (Rmax 2.5RU、1RU程度)で比較した。
SensorChip CM5では、二相性の見えるセンサーグラムで数値を採用できるようなフィッティングはできなかったが、PEGは数値を採用するに十分な1:1モデルフィッティングが可能で、両Rmaxの結果の同等性も高かった。(当ユーザー様のDiPIAポスター発表より)
2. Series S SensorChip NAについて(Instructionはこちら)
センサーチップ構造概略
- Neutravidinがあらかじめ固定化されたセンサーチップ
期待される効果・アプリケーション
- RYDアミノ酸配列を持たないNeutraAvidinは化合物の非特異的結合をStreptAvidinより少なくすることが期待されます。
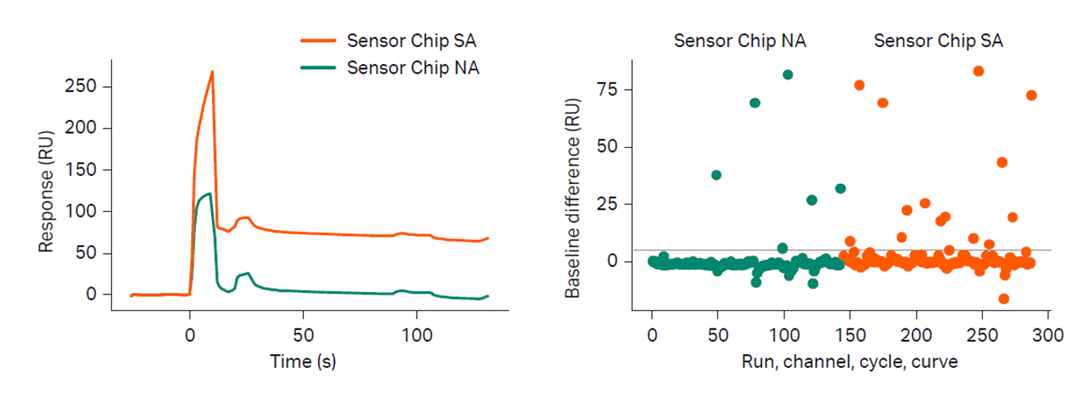
- SensorChip SAやBiotin CAPture kitより塩基性蛋白質の非特異的結合を軽減させることが期待されます。
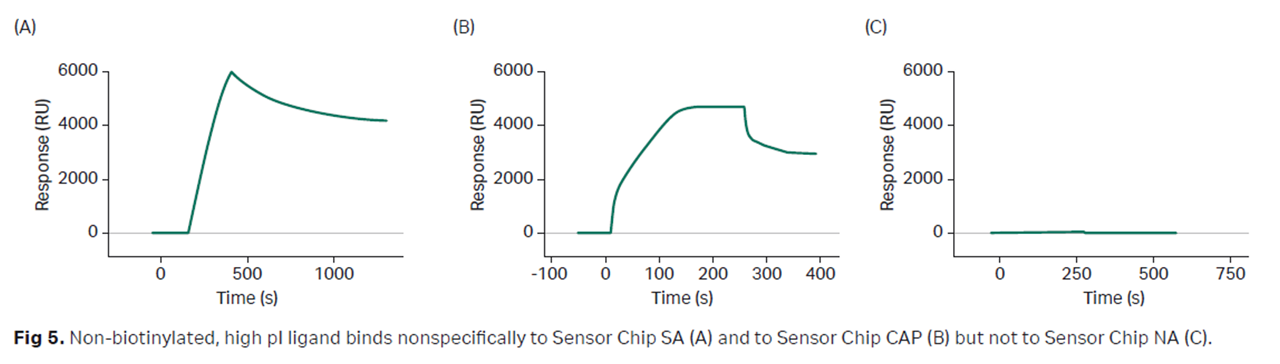
※ 上記データの詳細ポスターはこちら
注意点
- Series Sのフォーマットの製品のみ市販(Biacore™ X100などで使用できない)
- 酸など再生溶液に採用されることが多い溶液に対する耐性が弱い
非特異的結合に関しては本記事と合わせて合わせて既出記事の天敵「ノンスぺ」の見つけ方・退治法もご参照ください。
また、Biacore™ 消耗品選択ガイドをご覧いただくと今まで知らなかった消耗品の存在に気付くことがあるかもしれません。