いかにノンスぺ(=Non-Specific binding, 非特異的結合)のない測定データを得るかは、Biacore™で信頼性の高いデータを得るにはとても重要です。ソフトの機能や消耗品・ノウハウを十分活用してノンスぺを退治しましょう!
“ノンスぺ”(非特異的結合)があってもリファレンス(対照)セルのデータを取っているのだから差し引けば大丈夫でしょ、と思っている方いませんか?実は基本的にこれNoです。求める解析値に許容する誤差やノンスぺの大きさの程度問題にもよりますが、基本的にはBiacore™の測定解析値をきちんと意味ある正確な数値にするためには、ノンスぺはリファレンスセルで正確に差し引けない、という考えを出発点としたほうがよさそうです。また一言でノンスぺといっても、非特異的結合をしてしまう相手が何か(リファレンスか標的リガンドか)によってもその見つけ方・退治法も異なってきます。今日はそのあたりの話題をまとめたいと思います。
ノンスぺの種類とそれぞれの定義
A. リファレンスに結合するノンスぺ
センサーチップそのものやリファレンスに固定化したキャプチャー分子などに非特異的に結合する成分
B. 標的リガンドに結合するノンスぺ
標的リガンド上の特定部位(エピトープや結合ポケットなど)以外の部位に非特異的に結合する成分
AとBのノンスぺをどちらもできるだけ取り除かないと、スクリーニングやキャラクタリゼーションにおいて定数化したい場合の誤差要因になりえます。
ノンスぺの見つけ方
※A および Bは上述のノンスぺの種類に対応します
A-1.ソフトウエアのツールを用いてまとめて見つける
1. 一般
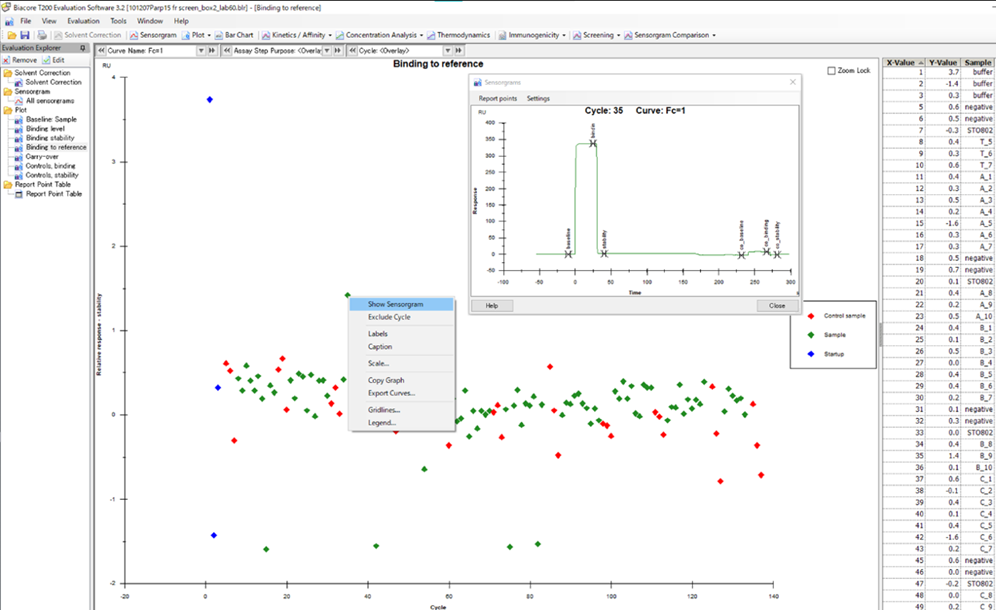
デフォルトで設定されているプロット(Biacore™ T200を例に。Binding to Referenceなど)の利用 解析ソフトウエアにBinding to referenceなどのプロットがdefaultで用意されています(T200の解析ソフトでは左側)。これは各サイクルのアナライト添加後に設定されている” stability”のレポートポイントのリファレンスセルでのレスポンスをプロットしたものです。もしリファレンスセルにノンスぺがある場合はstabilityのレポートポイントが上昇するはずですので、まとめてノンスぺ疑いのあるプロットを絞り込むことができます。最終的に疑いのあるプロットを右クリックすることでセンサーグラム形状を確認することもできます。そのうえで、そのプロットのデータをこの先の評価対象から外したい場合は“Exclude Cycle”から外すことが可能です。
2. フラグメント化合物の場合
フラグメントスクリーニングの場合は、Clean Screenという専用のメソッドがあります(Biacore™8K/8K+、S200)。これは、ベースラインの高さが各サイクルで直前のサイクルより上昇しているかをプロットして評価するものです。この方法ではフラグメントの結合量などを評価することはできませんが、センサーチップ表面や標的リガンドにノンスぺを示すような物性を示しライブラリから排除する必要があるようなフラグメントかどうかを判定します。その次にBinding Level Screenのステップでフラグメントそのものの結合を測定します。
A-2. ひとつずつ見つける
アナライトの数が少ないときにはひとつずつリファレンスへのノンスぺの有無を確認してもそれほど時間はかかりません。よく、Fc2-1などの差し引きセンサーグラムがマイナス方向になるデータを見てなんでだろう?と悩んでいる方がいたりするのですが、多くの原因はこのリファレンス側にノンスぺがついている、ということです。
リファレンスセルはリガンドが固定化されていない分、リガンド以外のリファレンスに相当する部分の露出面積がアクティブセルよりも相対的に大きくなるので、大きなノンスぺがリファレンスについた場合、差し引きしたセンサーグラムはしばしばマイナス方向のレスポンスを見せます。冒頭申し上げた、正確にノンスぺを差し引くのは難しい、というのはこのようなことが原因となっています。
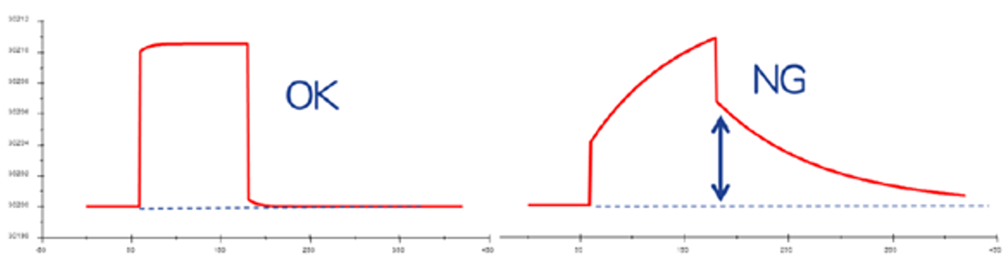
本題に入りましょう。ひとつずつノンスぺを確認する場合も考え方としてはA-1.と同様です。(と言いますか、ひとつずつ確認する方法を自動化したのがA-1.で述べたソフトウエアの機能、ということになります)リファレンスセル側に下の右図(Cytiva Webinar “正しいデータ、取れていますか“より)のよう添加後に少しレスポンスが残っている場合はノンスぺと判定します。左図の様に箱型で添加終了とともにベースラインに戻るようなレスポンスは、溶媒組成の差によって生じる”バルクレスポンス“と判定されます。(厳密にいえば非常に速い結合解離を示すノンスぺである可能性も完全否定はできないですが。)
B-1. ソフトウエアのツールを用いてまとめて見つける
1. 一般(主にスクリーニング時、Biacore™ T200を例に。Biacore™8K/8K+、T200/S200で使用可能)
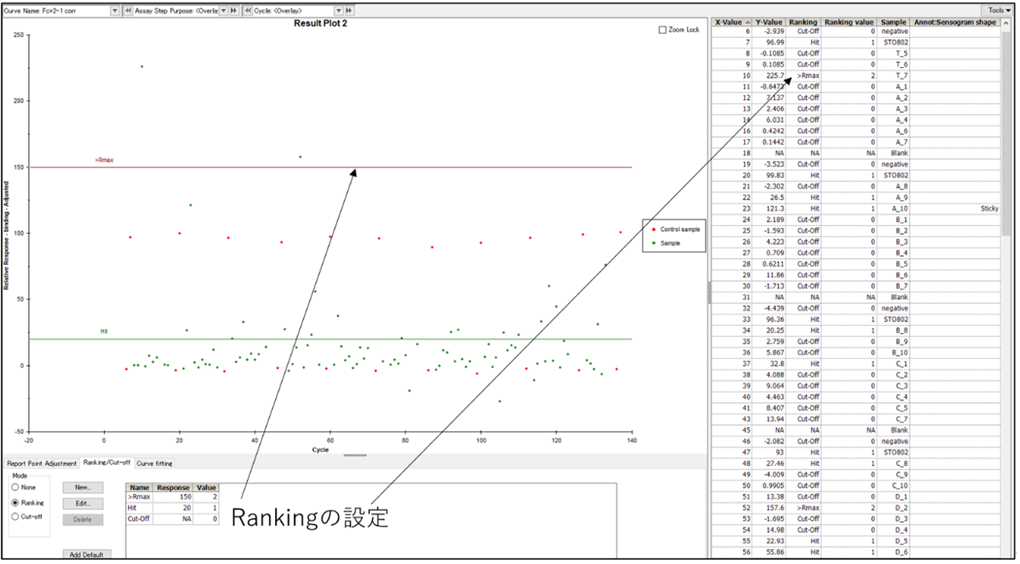
スクリーニングなどの数多くのアナライトを単一あるいは少ない濃度点数で測定する場合は、ソフトウエアのツールを使うことで、効率よく標的リガンドに対するアナライトの結合にノンスぺが含まれるかどうかを判別することが可能です。そのひとつがRanking機能の活用です。Ranking機能は、取得したプロットに対して、測定者が設定した範囲のレスポンスに対して閾値を複数設定し、それぞれの範囲に対して“フラグ”を立てることができる機能です。標的リガンドに対するアナライトのレスポンスにノンスぺが含まれているかどうかの一つの有力な基準が、
得られたレスポンス>理論的Rmax
というものです。
理論的Rmaxの高さ(理想的にはポジコンの結合量の情報があれば、そこから計算されるリガンドのActivity(%)を乗じたRmax)にこのRankingの閾値を設定することにより多数のプロットに対して、一括してノンスぺが含まれているか(Rmaxより高くないか)を判定することができます。
注:この基準に合致することはノンスぺを含む可能性が高という判定をすることができますが、合致しない検体がノンスぺを含まない、ということを判定する基準ではありません。
2. フラグメント化合物の場合(主にスクリーニング時、Biacore™8K/8K+、S200で使用可能)
フラグメント化合物の場合は少し特殊なノンスぺ発見ツールがあります。フラグメントスクリーニングは非常に弱いアフィニティの化合物をもHitとされ、多くの場合センサーグラム形状も”箱型”になります。そこできれいな箱型でないセンサーグラム形状でないものはノンスぺ(ソフト中ではBinding Behaviorが良い、悪いという表記になったりもします)を含んでいる、としてプロットの色を分けて認識表示する機能があります。
つまり、数多くのプロットの中でセンサーブラムの形状が箱型でないものを自動的に色を変えてくれますので、次にそのプロットだけ実際にセンサーグラムの形状を”show sensorgram”で確認して、採用するかどうかを効率よく決めることができる、というものです。
B-2. ひとつずつみつける(主にka、kd、KD算出時)
こちらは、メルマガBiacore™コンシェルジュ4月号記事「Rmaxのトリセツ」を改めてご覧いただいてもいいかもしれません。ka、kdやKD値を求めるために必須となる条件は、取得したセンサーグラムが結合部位特異的な相互作用を反映したものである、ということです。言い換えると非特異的結合成分の多いセンサーグラムにいくらフィッティング計算をしても意味のある数値を算出することは不可能です。このとても重要な結合部位への特異的結合の確認手法として、以下の式があります。
実測Rmax≦理論的Rmax
さて、このことは大変基本的かつ重要なことなのですが、今回さらにもう少し踏み込んで、さらにセンサーグラムの形状から「あ、これノンスぺが入っているな」を見るコツを少しお話したいと思います。
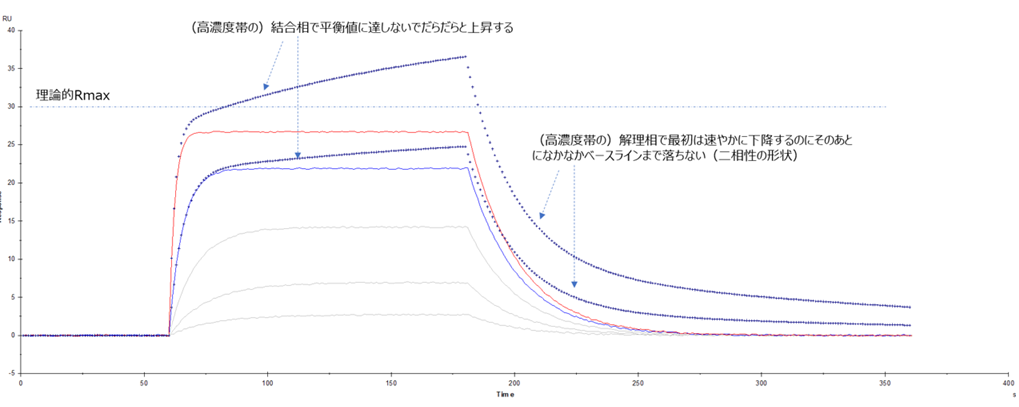
下図に、5濃度のセンサーグラムセットのうち高濃度側2濃度に色付け(赤と青)したものと、点線で表したものを描きました。このように非特異的な結合(が含まれる場合)は理論的Rmaxを超えたレスポンスを示す上に、結合相、解離相ともに” 二相性”を示すことがよくあります。
注:本来の特異的結合様式が1:1ではない場合は二相性の形状だけで非特異的結合とは言えないときもあります
ノンスぺの退治法
※A および Bは上述のノンスぺの種類に対応します
A-1.センサーチップの選択
Biacore™はさまざまなセンサーチップがございます。本記事では“ノンスぺ”という切り口でこれらセンサーチップの違いをご紹介したいと思います。
- Sensorchip PEG
デキストランではなくPEGを二次元的にチップ表面上に配置したセンサーチップです。センサーチップへのノンスぺを大きく軽減することが期待できますが、固定化量は低く、低分子アナライトの測定には基本的には不向きです。 - Sensorchip C1
チップ表面に直接カルボキシル基が配置されている構造です。デキストランを誤認識するようなアナライトの場合には有用です。これもセンサーチップCM5と比べると固定化量が低くなります。 - Sensorchip NA(Series Sのみ)
低分子化合物のスクリーニング時によく使われているSensorchip SAのストレプトアビジンが低分子化合物アナライトのノンスぺが比較的多いことで開発されたセンサーチップです。再生条件に制限があるので、一般的には再生が不要な低分子に対して利用されることが多いセンサーチップです。 - Sensorchip CM4
Sensorchip CM5のマイナスチャージ(カルボキシル基に由来する)を減らしたセンサーチップです。電荷的なノンスぺが疑われる場合に使われます。これも固定化量はやや低くなります。 - Sensorchip CM5 + His Capture kit
Sensorchip NTAを用いたときにノンスぺが多い場合に有効な時があります。 - Sensorchip CM5 + Antibody Capture kit
Sensorchip Protein AやProtein Gを用いたとき、検体中のFCSなどの血清成分のノンスぺが問題になるときに有効な時があります。
各センサーチップの説明書はこちらのリンクから、各製品ページ内のRelated documents内に保存されている説明書をご参照ください。
A-2. アナライトの品質のチェック
アナライトの品質が低い場合、つまり変性タンパク質が一定以上の割合で存在するような状況の場合は、ノンスぺを起こしやすくなるばかりか得られたka、KDの値の信頼性が落ちます。アナライトの結合活性濃度を求めるための手法としてBiacore™(T200、X100 plus package)にはCFCA(Calibration-Free Concentration Analysis)という手法がありますのでご参照ください。
「サンプルの”活性濃度”意識していますか?」や「Cytiva Webinar:試してみたくなるCFCA」もご参考になるかもしれません。
A-3. バッファーの選択
バッファーの選択でノンスぺを減らすという観点では一般的には以下の3つを満たすことが勧められます
- 一定の高さ以上のイオン強度(塩濃度)
※一般的には塩を生理食塩水程度の濃度に設定することが優先されることが多いですが。 - 0.05%のSurfactant P20 (Tween 20)
- 添加物はなるべく少なくする。
それ以外のバッファー条件を変更することでもノンスぺを減らすことができる可能性はありますが、トライアンドエラーの条件検討になりがちとなります。一つ興味深い例として(この例は厳密にはノンスぺということではないのかもしれませんが)添加物をなるべく少なくするという条件変更とともに低分子化合物の相互作用のセンサーグラム形状の安定性を改善した例があります。
現在一般的には低分子化合物の測定にはPBSベースのバッファー(しばしばTween™も添加)を標準的に使用しますが、この場合バッファー構成成分の一つのMgCl2の沈殿を避けてTrisベースのバッファーを用いています。このようにバッファー条件というのはノンスぺのやセンサーグラムの安定性の改善のために有効になりえます(下図)。
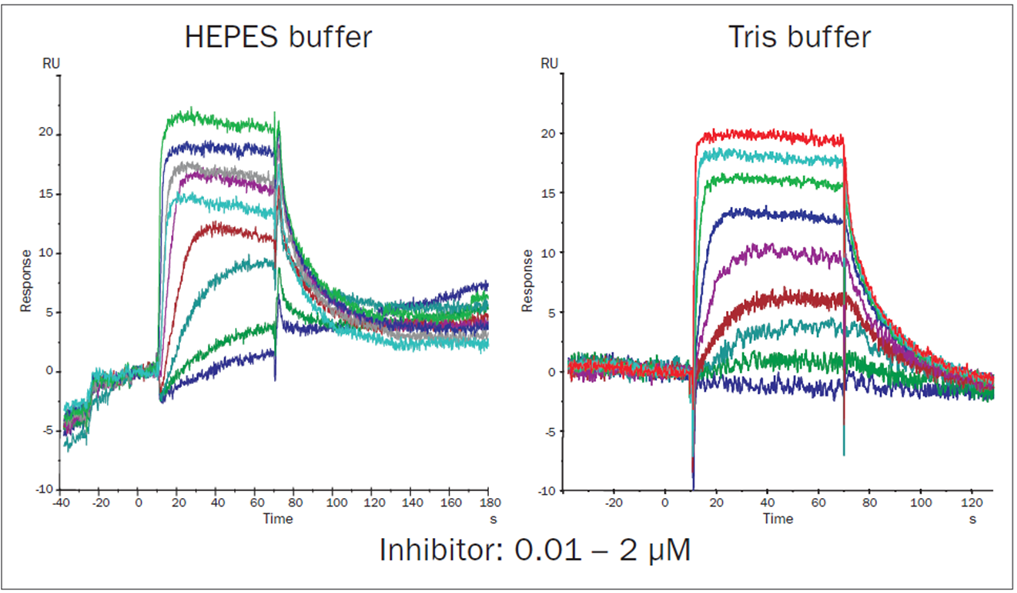
少し例外的なお話になるかもしれませんが、アナライト中の夾雑物のセンサーチップへのノンスぺを軽減するにはNSB Reducerという試薬がご利用する価値があるかもしれません。これはカルボキシルデキストラン溶液であり、アナライト中にあらかじめ混ぜておくことで、アナライト溶液中の夾雑物を吸着させて、添加時にセンサーチップに吸着させないような働きがあります。
血清サンプルなどにはよく使われる試薬です。精製アナライトを用いたキャラクタリゼーションの測定におけるアナライト分子自身のノンスぺを抑えるのには一般的には適当ではありません。
B-1. 固定化アプローチの選択
この条件検討は、特に標的リガンドをアミンカップリングで直接センサーチップに固定化して測定したところ、アナライトのリガンドに対するノンスぺが見られるような場合に、キャプチャー法を用いた固定化アプローチに変更することで奏功することが多いです。
これはアミンカップリングが比較的タンパク質にとって“優しくない”固定化手法であり、固定化プロセスによって変性するリスクが高いためです。
変性したリガンドタンパク質はノンスぺを引き起こしやすくなります。試薬キットのリストから、測定目的に沿ったキャプチャーキットのご利用を検討すると改善するかもしれません。
B-2. リガンド・アナライトの品質チェック
アナライトの品質チェックのお話は上記A-2で致しましたので、ここではリガンドの品質チェックについて述べたいと思います。
アナライトと同様リガンドも変性タンパク質を含むとそれだけノンスぺのリスクが高まります。B-1.の様に固定化に伴って変性タンパク質を含むような状態になるのであれば固定化アプローチの変更で改善の可能性は十分出てきますが、そもそものストックのタンパク質溶液の品質が悪い場合は再調製が必要になるケースもあります。
リガンド側の品質(=結合活性率, Activity%の確認方法はポジコンのアナライトがあると容易に確認することが可能です。ポジコンのアナライトを飽和濃度に達したときのレスポンス高(Actual (実測) Rmax)を取得して下式によって計算します。
Activity% = 100×(Actual Rmax/理論的Rmax)
この値が高ければ安心してポジコン以外のアナライトを添加してもノンスぺを起こすリスクは低くなります。またアナライトのアフィニティが弱い場合は必然的に添加濃度が高くなりますのでノンスぺのリスクが高まります。ポジコンよりアフィニティが弱いアナライトが多いと予想される場合にはこのActivity%をなるべく高くする環境にしたうえで測定された方がいいかもしれません。
B-3. バッファーの選択
A-4.と基本的には変わりません。
いかがでしたでしょうか。ノンスぺとの闘いは、多くの皆さまが経験されていることかと思いますが、何か今までお持ちの知識を補完するような情報がありましたら幸いに存じます。またこれ以外にも細かいノウハウなどもありますので、Tech-JPcytiva.comのお問い合わせもお気軽にご利用ください。