この記事は、自動翻訳ソフトウェアによって翻訳されています。自動翻訳によって生成された記事(Cytivaにより見直された記事を含む)には、単語、構文、文法などの間違いが含まれている場合があります。弊社は、コンテンツの不正確な翻訳またはその使用により生じる間違いや誤解、または損傷に対して責任を負いかねます。あらかじめご了承ください。
Anna Moberg, Staff Research Engineer
アデノ随伴ウイルス(AAV)は、生きた細胞に核酸を導入するためのベクターとしてますます一般的になってきており、科学者は主に遺伝子治療にこれを応用しています。
標準的な力価測定はELISA法を用いていますが、手作業が多く、精度や再現性に難があります。
このアプリケーションノートでは、アデノ随伴ウイルス(AAV)、セロタイプ2およびセロタイプ5の力価解析について、表面プラズモン共鳴(SPR)に基づく2つのアッセイの性能について説明します。両アッセイとも再現性のある結果が得られ、ELISAを用いた確立されたAAV capsid力価測定法と良好な相関があります。Biacore™アッセイはELISAと比較して、高度に自動化され精度が高く、ハーベストから最終精製バルクまでのプロセスサンプルに対応しています。その性能と使い勝手の良さから、プロセス開発ツールとしても非常に適しています。
Biacore™センサーチップに共有結合したAAV2特異的な抗体にウイルス粒子を結合させ、AAVセロタイプ2(AAV2)の力価を評価しました。
AAVセロタイプ5(AAV5)の力価は、Biacore™センサーチップにキャプチャーされたAAV5特異的な抗体にウイルス粒子を結合させることにより評価しました。どちらのアッセイもBiacore™ T200 SPRシステムを使って開発しましたが、濃度分析が可能なBiacore™ SPRシステムであれば、どのようなシステムでも応用できます。
はじめに
ウイルス粒子は、外来核酸を生細胞に導入することができるため、遺伝物質を導入するベクターとして適しています。ウイルスベクターは、遺伝子治療、細胞治療、癌免疫療法、腫瘍ワクチンなどのワクチンや治療への応用に高い可能性を示しています。一般的なウイルスベクターシステムには、アデノウイルス、アデノ随伴ウイルス、レンチウイルスがあります。
アデノ随伴ウイルス(AAV)は、遺伝子治療においてますます一般的になってきているベクターです。それまでは、アデノウイルス製剤の汚染物質と考えられていました。このタイプのウイルスは病気を引き起こすことは知られておらず、軽い感染症を引き起こすだけです。AAVは小さなウイルスで、ベクターとしての能力はより小さなヌクレオチド配列(<4.4 Kb)に制限されています。しかし、AAVのパッキング能力を向上させることを目的とした研究が進行中です[ref.1]。
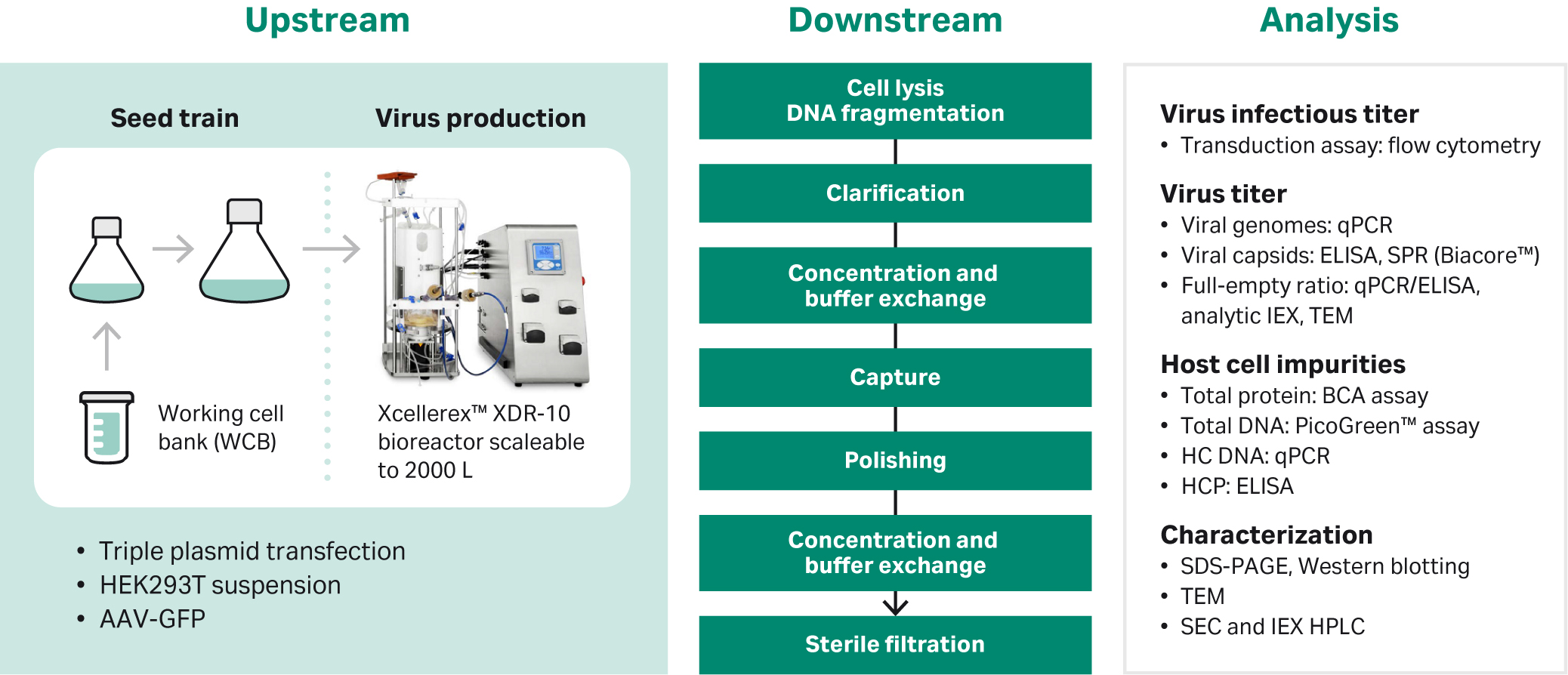
本アプリケーションノートでは、当社が開発したAAV血清型5の上流生産から最終精製品までの完全なアデノ随伴ウイルス生産プロセスの解析部分について述べます。生産・精製スキームの説明については、以下の図1を参照してください。より詳細な情報は、参考文献2、3、4、5を参照してください。
図1. AAV5の作製・精製スキーム
プロセス開発、最終生産、精製において、感染力価、ウイルスゲノム力価、ウイルス全粒子、宿主細胞タンパク質、DNAレベルなどの重要な品質特性をモニターしています。このために使用される技術の多くは、精度が低く、自動化の程度が低いため、労力がかかります。また、分析には時間とコストがかかることが多くあります。
SPRのような簡便で高精度な分析法は、高度な自動化により今日のワークフローを強化することができます。ここでは、AAV2およびAAV5の総力価解析にSPRを使用します。どちらのアッセイも、インタクトなウイルス粒子に特異的な抗体へのウイルス粒子の結合に基づくものです。
材料と方法
AAV2の力価解析
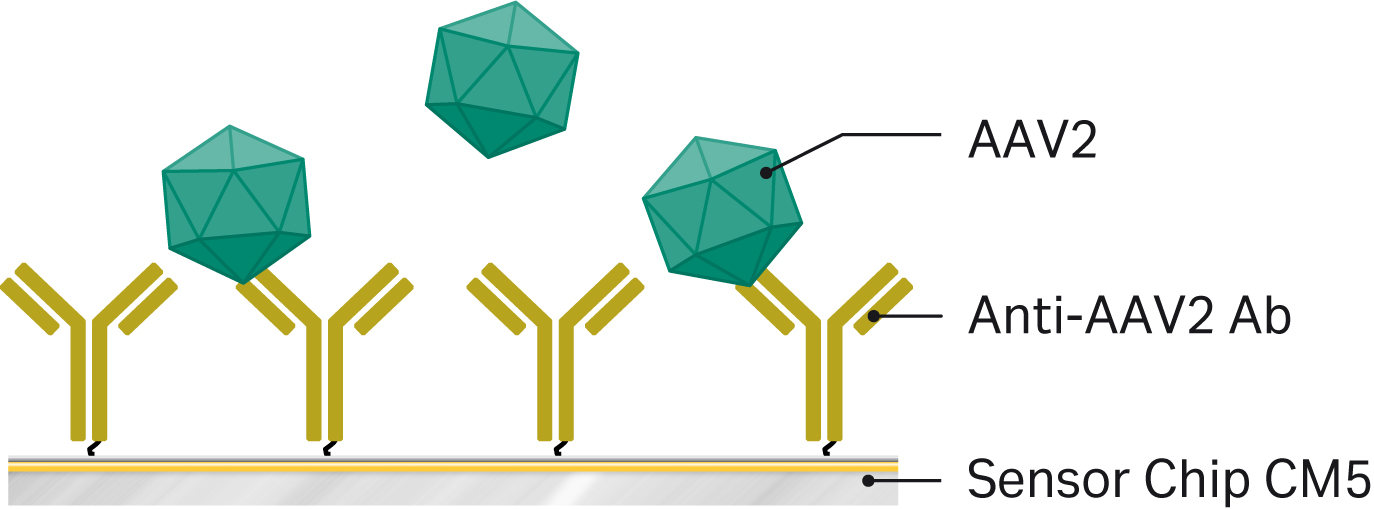
Biacore™ T200を用いたAAV2ウイルス総粒子価の測定法を開発しました。しかし、濃度解析をサポートするソフトウェアがあれば、どのBiacore™システムにも適用することができます。アッセイ原理を図2に示します。
図2. Biacore™ システムを用いたAAV2力価解析の原理。Biacore™ T200のセンサーチップ CM5上の1つのフローセルに抗AAV2抗体がアミンカップリングされている。NaCl添加のランニングバッファーで5~1000倍に希釈したAAV2試料を表面上にインジェクションし、検量線に対してウイルス感染価を評価する。
Progen社製抗AAV2抗体(Cat.No.610298)を、標準的なアミンカップリングとHBS-EP+をランニングバッファーとして、センサーチップCM5に固定化させました。その後、抗体を10mM酢酸pH5.0で20μg/mLに希釈し、7分かけて注入したところ、6000~10000RUの固定化レベルが得られました。固定化は25℃、1つのフローセルだけで行いました。
力価解析には、ランニングおよびサンプル希釈用バッファーとして、最終塩濃度が0.3MになるようにNaClを追加したHBS-EP+バッファーが使用されました。このNaCl添加により、粗サンプルからの非特異的結合を除去することができます。サンプルは通常、予想される力価に応じて5倍から1000倍に希釈され、各実験では各プロセスサンプルの2つの異なる希釈液を使用しました。サンプルは10 µL/minで400秒の接触時間で注入し、3 M MgCl2をを60秒注入して再生しました。その後、サンプルの完全性を保つため、サンプルコンパートメントの温度を10℃に設定し、25℃で分析を行いました。力価解析は、Biacore™の濃度分析で推奨されているように、リファレンスセルを使用せずに実施しました。
AAV2 ATCC standard (ATCC AAV2 reference standard VR-1616) を用いて、2倍希釈系列で 3.6 × 108 から 9.2 × 1010 VP/mL までの範囲で検量線を作成しました。最初の検量線はサンプルの前に、2番目の検量線はサンプルの後に測定しました。このアッセイには、バッファーと再生による 5~10 回のスタートアップサイクルが含まれます。
力価解析で使用される抗AAV2抗体は、インタクトなウイルス粒子のみに特異的です。つまり、このアッセイを使用すれば、遊離ウイルスや宿主細胞のタンパク質による干渉を受けずに、粗製細胞培養サンプル中のAAV2力価をモニターすることができます。ベンダーの仕様によると、この抗体はAAV3に特異的です。つまり、標準品、再生、接触時間、校正範囲、その他のパラメータを最適化した後、このセロタイプにアッセイを適用することも可能です。
AAV5の力価解析
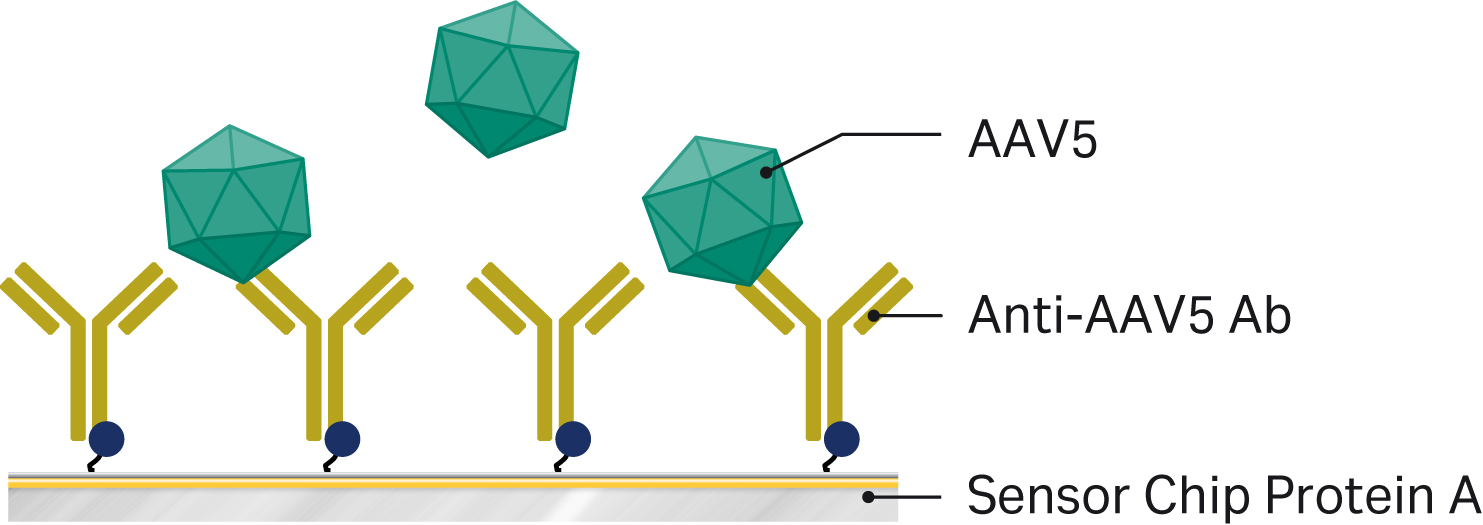
また、Biacore™ T200を使用して、AAV5ウイルスの力価を解析しています。このアッセイはセンサーチップのプロテインAへのキャプチャーを使用して実行され、別途固定化する必要はありません。このアッセイでは、結合抗体の関係で、共有結合ではなく、キャプチャーの形式を採用しました。初期のテストでは、抗体が酸性のpHに敏感であることがわかり、この手順では酸性のバッファで希釈する必要があるため、アミンカップリングは除外されました。キャプチャーは中性pHで行われるため、抗体にはより穏やかな条件です。図3に測定原理を示します。
図3. Biacore™ システムを用いたAAV5力価解析の測定原理。Biacore™ T200のセンサーチップProtein A上の1つのフローセルに抗AAV5抗体がキャプチャーされている。5~1000倍に希釈したAAV5サンプル(塩を加えたランニングバッファー)をセンサーチップ上にインジェクションし、検量線との比較によりウイルス力価を評価する。
Progen社製抗AAV5抗体(Cat. No. 610148)をランニングバッファーで16μg/mLに希釈し、シングルフローセルでセンサーチップ上にキャプチャーしてからAAV5ウイルスサンプルを注入しました。接触時間240秒、流速5 µL/minでキャプチャーを行いました。
サンプル注入は、接触時間120秒、流速10µL/minで行いました。30秒間の10 mM glycine-HCl pH 1.5による再生で、キャプチャーした抗体とウイルスはセンサー表面から除去されます。各サイクルにおいて、新しい抗体がキャプチャーされます。サンプル保存のため、サンプルコンパートメント温度は10℃、分析温度は25℃に設定しました。ランニングおよびサンプル希釈用バッファーとして、最終塩濃度が500 mMになるように余分なNaClを添加したHBS-EP+を使用しました。サンプルは予想される力価に応じて10倍から1000倍に希釈され、各サンプルの異なる2つの希釈液が通常実行されます。Vigene Bio pAV-CMV-GFP (Full) AAV5 (art.No. CV10005) を標準品として、1.7 × 1010 ~ 5.8 × 1011 VP/mL の範囲で検量線を作成しました。バッファーと再生で5-10回のスタートアップサイクルを行い、サンプル前に1回目の検量線、サンプル後に2回目の検量線を作成し、アッセイを実施しました。
抗AAV5抗体はインタクトなウイルス粒子に特異的であり、遊離ウイルスや宿主細胞タンパク質による干渉がないため、このアッセイは細胞培養サンプルの分析に適しています。
AAVアップストリーム・ダウンストリームのサンプル
アップストリームとダウンストリームのワークフローの異なるステップからサンプルを採取し、サンプルマトリックスと予想される力価に大きなばらつきを持たせました。詳しくは図1をご覧ください。
結果および考察
AAV2力価解析
アッセイの安定性
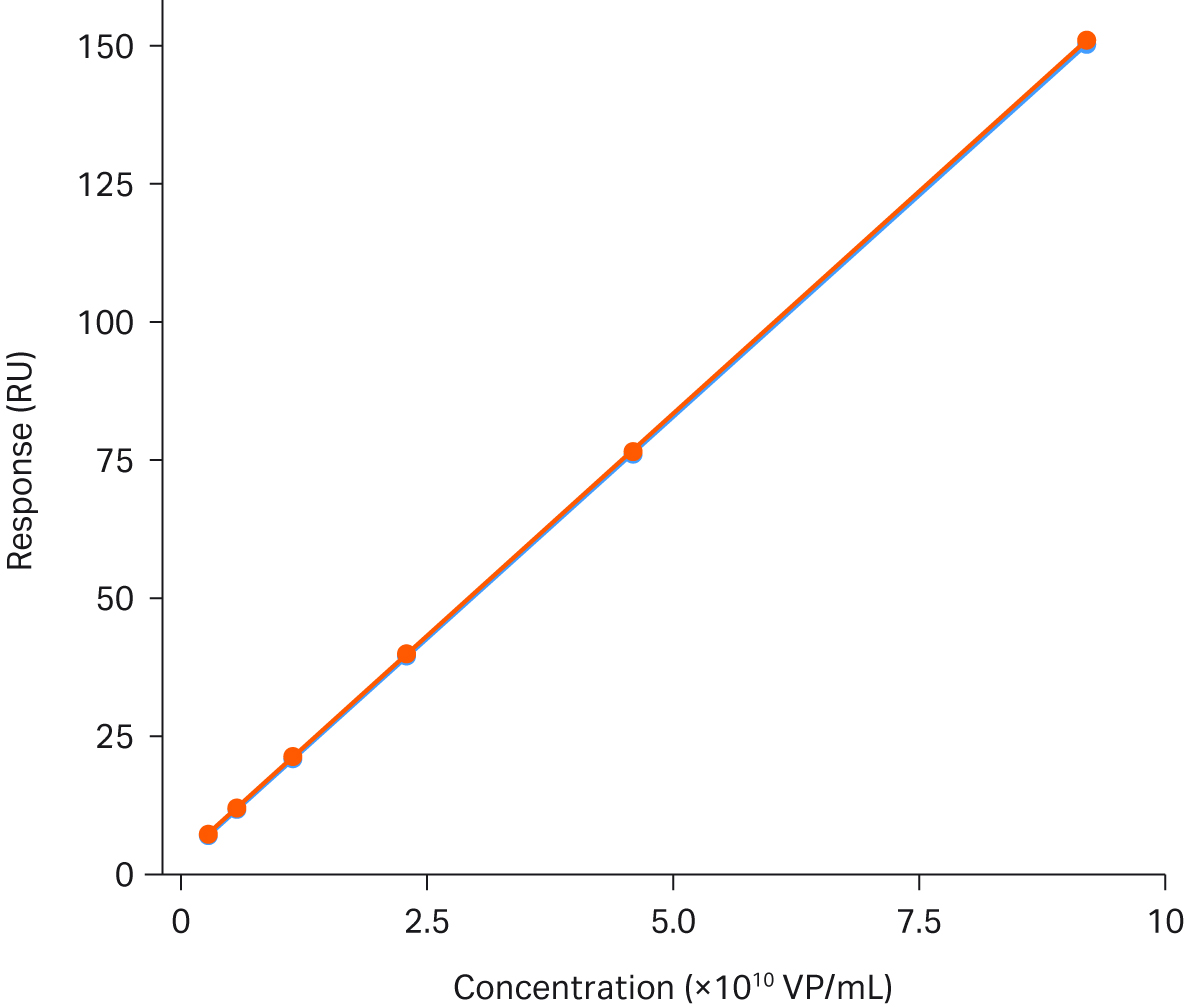
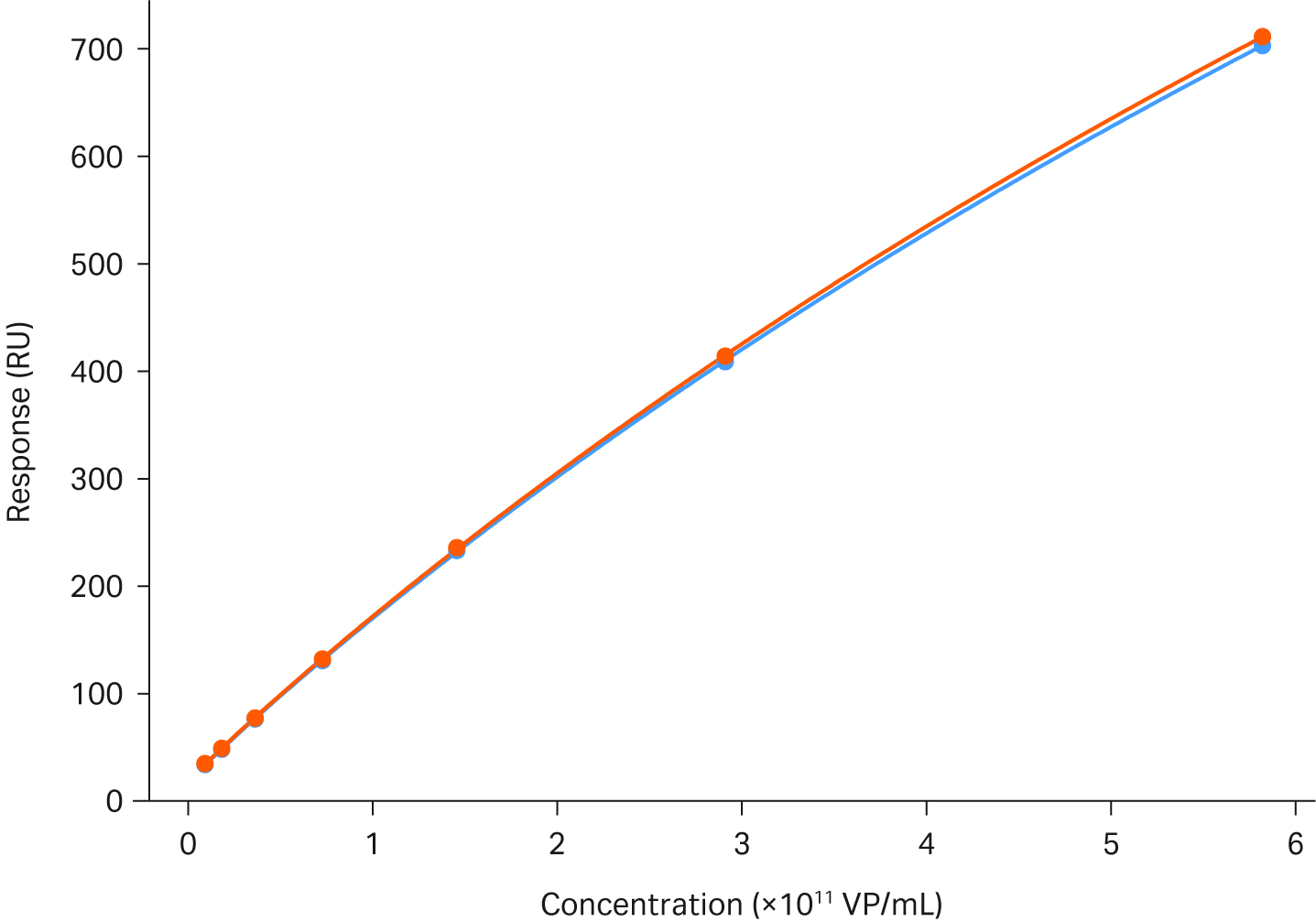
図4は、AAV2力価アッセイの安定性を説明したものです。この図は、2つのキャリブレーションカーブを完全に重ね合わせ、その間に66サンプルを走らせたものです。
図4. Biacore™ T200を用いたAAV2の力価解析。図は、66サンプルを挟んで実行した2つのキャリブレーションカーブの重ね合わせです。検量線の範囲は、3.6 × 108 ~ 9.2 × 1010 VP/mLです。
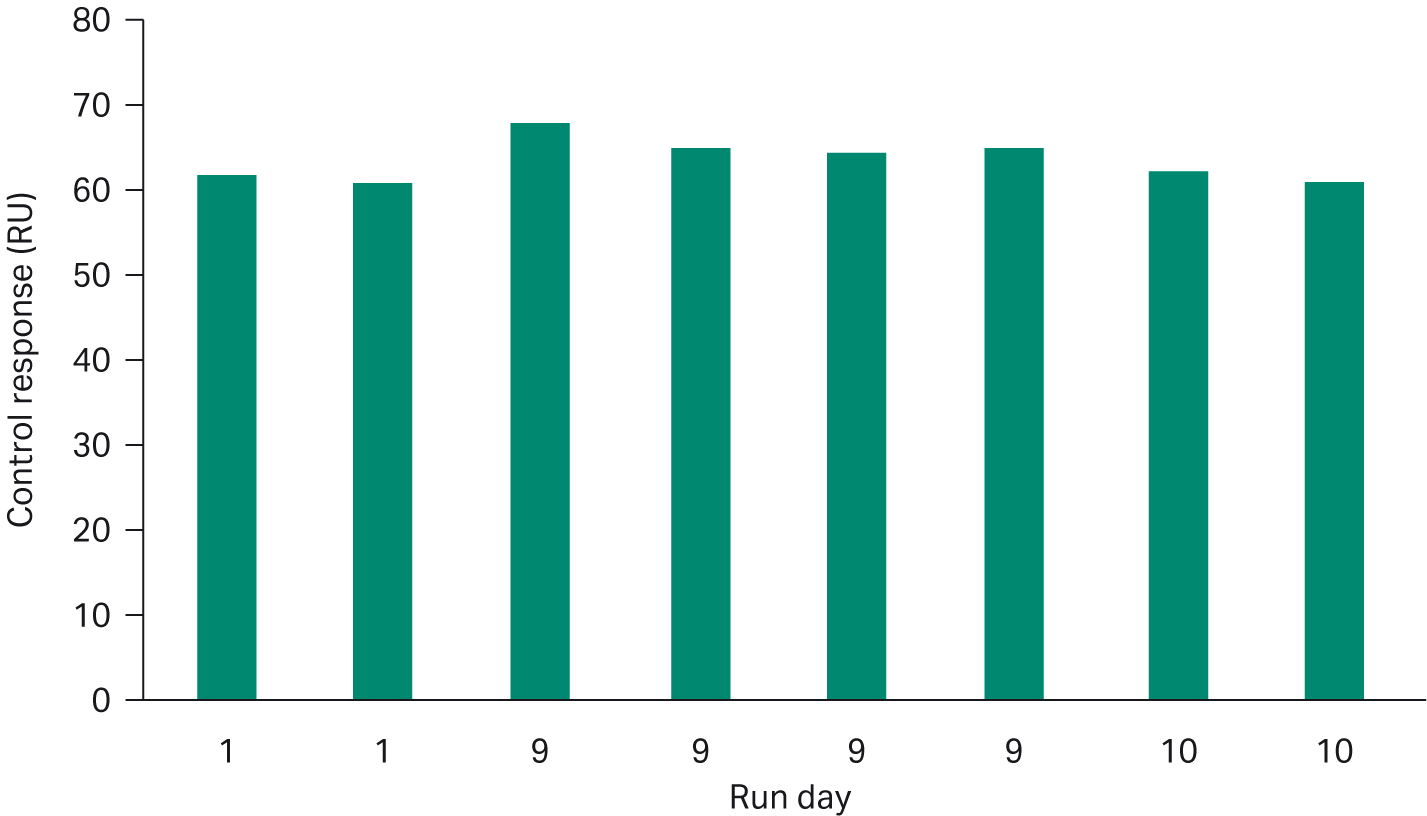
アッセイを開発する際、固定化チップは、推奨される実行条件下で少なくとも連続10日間、複数の実行で使用できるほど安定であることがわかりました。この高い安定性は、マスターキャリブレーションカーブ(1日目に実施した検量線が、その後のランのサンプル評価に使用される)にも対応しています。私たちは、各ランに社内のポジティブコントロールサンプルを含めることで、固定化チップの性能をモニターしています。図5は、同じ固定化センサー表面で10日間にわたって行われた3回のランから得られたポジティブコントロールの応答レベルを示しています。コントロールのレスポンスレベルの相対標準偏差は4%未満です。マスターキャリブレーションカーブは、高価なスタンダードを節約し、結果を得るまでの時間を短縮するのに役立ちます。
図5. 同じ固定化センサーチップを用いた3回の分析で得られたポジティブコントロールの10日間にわたる応答。コントロールの繰り返し測定の相対標準偏差は4%未満である。
標準品の安定性
AAV2 ATCC標準品は、500 µLの冷凍分注ロットでドライアイスで配送され、受領後-80˚Cで保管されます。初回使用時は、ATCCバイアルを解凍し、Protein LoBind Eppendorfバイアルに15 µLずつ分注します。その後、-80℃で保存しています。解析のたびに、新鮮な15μL分注ロットを解凍します。
注意深い取り扱いにもかかわらず、ATCC分注ロットは時間の経過とともに徐々に活性を失い、検量線の応答範囲の減少として観察されました。同じ期間、ポジティブなインハウスコントロールの応答レベルには差が見られませんでした。標準品の活性が低下し、応答レベルが低下した結果、試料のウイルス量が過大に評価されました。ATCC標準品の分注ロットを解凍したばかりの標準品とアッセイランで比較しました。その結果、新ロットの応答レベルは旧ロットの2倍となり、旧ロットの活性が低下していることが確認されました。
この安定性の問題は、分析のために冷凍庫から標準品を取り出す際に、誤って凍結融解してしまうなど、不適切な取り扱いが原因であったと思われます。室温への露出を最小限に抑え、より厳格に取り扱うことで、標準品の寿命は大幅に延びました。高性能な分析のためには、ATCC標準品を常に適切に取り扱うことが不可欠です。
AAV2力価アッセイにおけるLODとLOQ
ネガティブハーベストサンプルのバックグラウンドシグナルから検出限界(LOD)、定量限界(LOQ)を算出しました。陰性サンプルを3回連続で10回測定し、平均応答と標準偏差を算出した。そして、LOD(RU)は平均+3*標準偏差、LOQ(RU)は平均+10*標準偏差として算出しました。標準曲線を読み取ることにより、LODは約2×109 VP/mL、LOQは約5×109 VP/mLと推定されました。
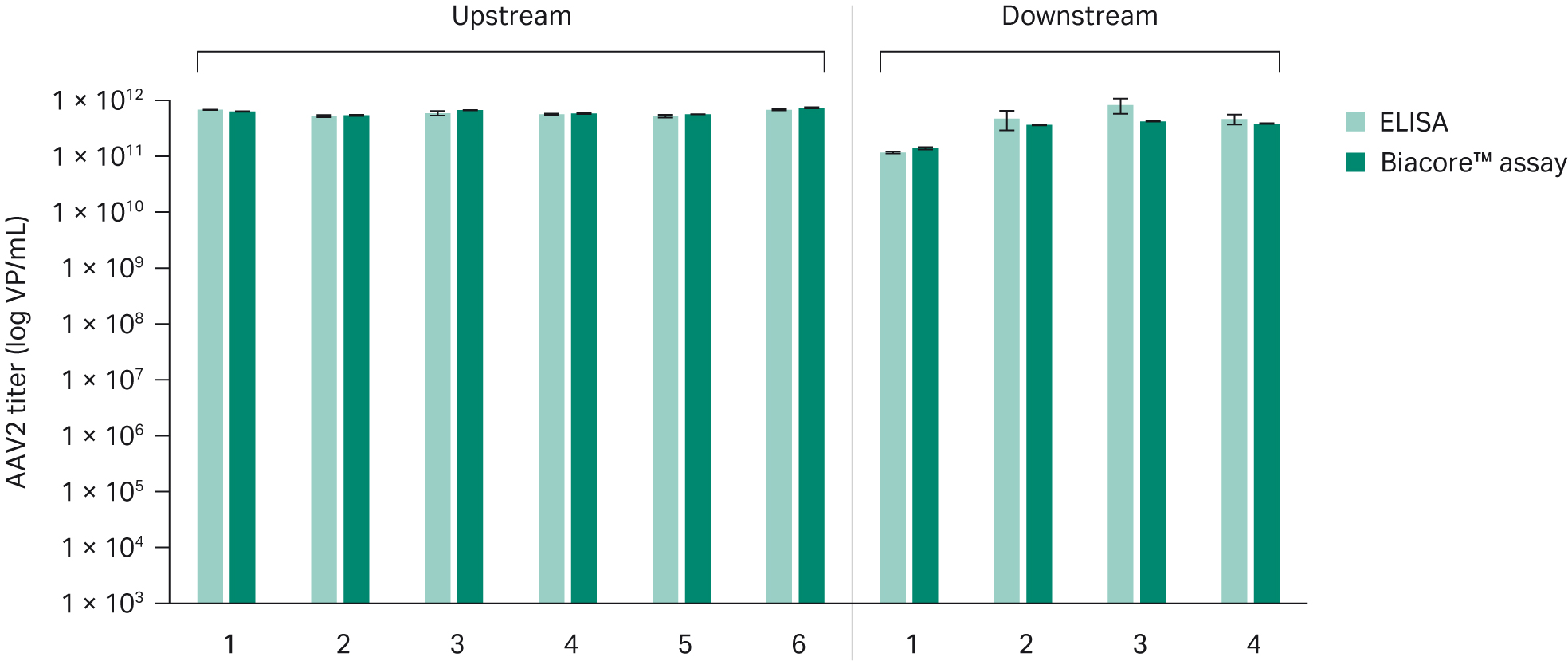
ELISAとの比較
Biacore™ AAV2 力価アッセイとELISA(Progen AAV2 Titration ELISA, art no.PRATV)を比較しました。上流工程の収穫物サンプルと下流工程のサンプルの両方について分析を行いました。その結果、Biacore™アッセイとELISAは良好な相関があることが確認されました。Biacore™アッセイのアッセイ内精度は3%で、ELISAの20%以上の精度に比べて著しく低いことが確認されました。
図6. アップストリームおよびダウンストリームサンプルのAAV2力価をELISA法とBiacore™アッセイ法で測定した場合の比較。
Biacore™ 8Kを用いたAAV2力価解析
サンプルのスループットを大幅に向上させるBiacore™ 8Kシステムでアッセイをセットアップしました。
Biacore™ 8Kは、2つのシリアルフローセルと8つのインジェクションニードルが並列に動作する8チャンネルを備えています。この並列構成により、パラレル濃度分析が可能になります。パラレル濃度実験では、検量線はチャンネルごとに1つの検量線ポイントで、チャンネルを横断して実行されます。このため、検量線は1サイクルで済みますが、検量線を別々のサイクルで実行するシリアル設定とは異なります。パラレルアッセイでは、検量線に同じ範囲を使用し、同じ接触時間を使用します。チャンネル間のわずかな差を補正するために、Normalizeサイクルが実行に追加されます。実用的な理由から、正規化溶液はキャリブレーションポイントの1つとすることができます。並列検量線と8つのサンプルを並行して実行することにより、総実行時間を大幅に短縮することができます。96ウェルプレート1枚分のサンプルでは、シングルニードルシステムの19時間に対して、本システムは3時間未満にランタイムを短縮しています。
図7. Biacore™ 8Kでは、8つのサンプルを同時にアッセイすることができ、ランタイムを大幅に短縮することができます。
AAV5力価解析
アッセイの安定性
AAV5力価アッセイは、キャプチャーアッセイとして設定・実行されます。つまり、抗AAV5抗体のキャプチャーがサイクルごとに実行されます。この方法では、表面はサイクルごとに新しいとみなされるため、AAV2力価のようにマスターキャリブレーションカーブを使用することができません。しかし、抗AAV5抗体のキャプチャーに使用するセンサーチップ、センサーチッププロテインAは非常に安定であり、表面の性能を変えることなく複数の実験に再利用することが可能です。Vigene フルスタンダードを用いた検量線を図8に示します。
図8. Biacore™ T200を用いたAAV5の力価解析。図は、16サンプルを挟んで実行した2つのキャリブレーションカーブの重ね合わせです。検量線の範囲は、9.1 × 109 ~ 5.8 × 1011 VP/mLです。
標準品の安定性
AAV5アッセイのスタンダードとして、Vigene Full Standardを使用しました。25μL の標準液を調製し、-80℃にて保存しました。新しい分析のたびに、新しい分注ロットを冷凍庫から取り出しました。プロジェクト期間中、この標準物質の安定性と活性の低下に関する問題は発生しませんでした。Vigene 社の標準品は、AAV2 ATCC 標準品よりも温度感受 性が低いように思われました。
AAV5 力価アッセイの LOD および LOQ
3回連続で10回測定し、陰性サンプルの平均応答と標準偏差を算出しました。そして、LOD(RU)を平均+3*標準偏差、LOQ(RU)を平均+10*標準偏差として算出しました。その結果、LODは9.8 × 109 VP/mL、LOQは1.7 × 1010 VP/mLと推定されました。
ELISAとの比較
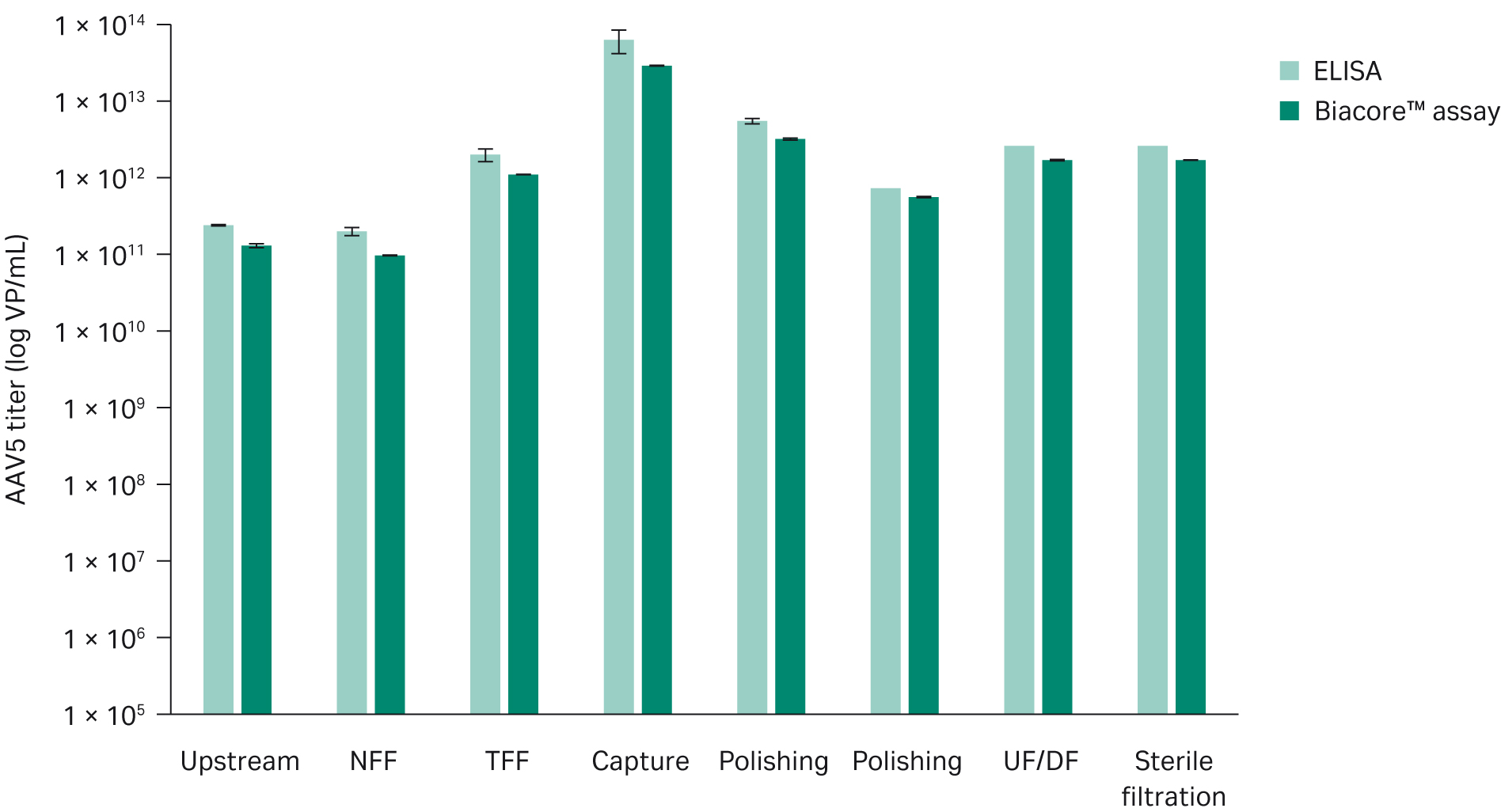
AAV5プロセスのアップストリームおよびダウンストリームサンプルのBiacore™解析を行い、ELISA法(Progen AAV5 Titration ELISA、品番:PRAAV5)と比較しました。その結果、Biacore™解析の力価はわずかに低く、よく相関していました(図9)。しかし、両アッセイ間の力価の差は小さく、Biacore™アッセイは非特異的結合を減らすように最適化されており、ELISAは標準バッファーの条件で実行されるため、実行条件の差に起因すると思われます。つまり、ELISA法では非特異的結合が存在する可能性があります。
このサンプルセットでは、Biacore™アッセイの平均測定精度は2%、ELISAでは15%と判定されました。
図9. 異なるタイプのAAV5アップストリームおよびダウンストリームサンプルにおける、ELISA法とBiacore™アッセイ法によるウイルス量の比較。ELISAの方がやや高い力価が得られているが、これはELISAプレートへの非特異的な結合によるものと思われる。
結論
Biacore™ AAV力価アッセイは、ELISAを用いた確立された方法とよく相関する、堅牢で再現性のある結果を生み出します。Biacore™力価アッセイはELISAと比較して、アッセイのばらつきが非常に少ないです。Biacore™アッセイは自動化されており、最小限の作業時間、簡単なサンプル前処理、自動化されたデータ評価など、より効率的です。また、Biacore™のセンサー表面は何度も再利用できることも利点です。AAV2の力価解析では、マスターキャリブレーションカーブを用いて、同じ固定化センサーチップを少なくとも10日間まで使用できますので、標準液とコストを節約できます。AAV5アッセイで使用したセンサー表面、センサーチップProtein Aも非常に安定で、数回の分析に再利用することが可能です。
どちらのアッセイも濃度分析に対応したBiacore™ SPRシステムで適用することができます。Biacore™ 8KまたはBiacore™ 8K+システムでアッセイを実行すると、サンプルのスループットが大幅に向上し、総実行時間が短縮されます。Biacore™ アッセイは品質管理だけでなく、プロセスの最適化にも優れたツールです。
参考文献
- Choi, JH., Yu, NK., Baek, GC. et al. Optimization of AAV expression cassettes to improve packaging capacity and transgene expression in neurons. Mol Brain 7, 17 (2014). https://doi.org/10.1186/1756-6606-7-17
- Application note: AAV5 capture and polishing optimization
- Application note: AAV5 purification including analytics
ご注文について
| Product information |
Information |
Product code |
|---|---|---|
| Series S Sensor Chip CM5 Pack of 3 |
Pack of 3 |
BR100530 |
| Series S Sensor Chip Protein A |
Pack of 3 |
29127556 |
| Amine Coupling Kit |
Reagents for immobilization |
BR100050 |
| HBS-EP+ Buffer 10x |
Analysis buffer |
BR100669 |
| Glycine 1.5 | Regeneration solution |
BR100354 |
| Acetate 5.0 |
Coupling buffer |
BR100351 |
| Biacore™ T200 |
SPR system for characterization of molecular interactions |
28975001 |
| Biacore™ 8K |
SPR system for characterization of molecular interactions |
29337763 |
| Biacore™ 8K+ |
SPR system for characterization of molecular interactions |
29283382 |