
|
|||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > ウェスタンブロッティング |
|||||||||||||||||||||||||||||||||||
SDS-ポリアクリルアミドゲル電気泳動の原理良好な結果を得るためのKey Point分子量マーカーの選択分子量マーカーの移動度から得られた検量線をもとに、目的タンパク質の分子量を算出します。正確な分子量測定には色素が結合していないマーカー(スタンダードマーカー)を用います。有色マーカー(マーカータンパク質に異なる色素を結合)は、泳動状態の確認やSDS-PAGE後のメンブランへのブロッティング効率の確認に有効です。 ゲル濃度の選択分離するタンパク質の分子量に対応したポリアクリルアミドゲル濃度(ポアサイズ)を選択することが重要です。 電気泳動装置の選択スクリーニング目的には、泳動距離の短いミニゲル用泳動装置、分離を高め大きく展開するには、泳動距離が長く大きなゲルが泳動できる装置を選択します。さらに、ゲル作製の手間が無く再現性に優れた結果を得るにはプレキャストゲルの使用が有効です。発熱によるバンドの歪みを抑えるために、ゲル全面を冷却できる電気泳動装置を用います。 サンプル調製方法サンプル中の塩濃度をなるべく下げ、サンプル間の塩濃度差を小さくします。フレッシュなサンプルバッファー保存液(-20℃保存)を使用して、タンパク質の変性を完全に行います。不完全な変性はアーチファクトの原因になります。 分子量の測定法図4は分子量既知のタンパク質分子量マーカーをSDS-PAGEした結果です。移動度は先行色素(ブロモフェノールブルー)をRf = 1.00 とした相対的移動度で表しています。分子量の対数と移動度との間には良好な直線関係が認められます(図5)。分子量マーカーと同一スラブゲル上にサンプルを展開することで、サンプル中のタンパク質の分子量を推定することができます。 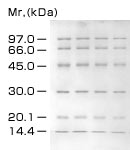 図4. SDS-PAGEのパターン 縦型ミニゲル電気泳動装置(Mighty Small electrophoresis unit)を用いてSDS-PAGEを行いました。サンプルはLaemmli 系のサンプルバッファーでLow Molecular Weight Calibration Kit for SDS Electrophoresisを等倍希釈して、アクリルアミドゲル(15 %T、2.7 %C)にそれぞれ3 μlアプライしました。電気泳動は、20 mAの定電流、55分間で行ないました。泳動後のゲルは、CBBで染色しました。 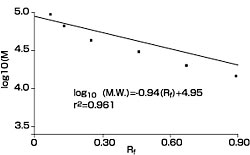 図5. SDS-PAGEによる選択曲線
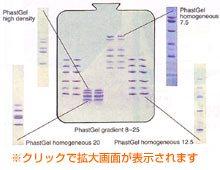 図6. PhastGel™のグラジエントゲルとホモジニアスゲルの分画範囲 ホモジニアスゲルは、近接したタンパク質バンドの距離を広げ分離を向上することができます。 中央のゲル:PhastGel™ gradient 8-25 サンプル:レーン1、2、7、8 LMW Marker Kit(コード番号17-0446-01)、レーン3、4 PMW*、レーン5、6 HMW SDS Marker Kit(コード番号17-0615-01) *PMWは現在販売しておりません 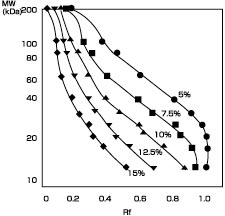 図7. 標準タンパク質の移動度とポリアクリルアミド濃度の関係 タンパク質マーカーを5 種類の濃度のポリアクリルアミドゲルでSDS-PAGEを行ない、結果をプロットしました。
染色法ポリアクリルアミドゲルに展開したタンパク質の検出には、色素を用いた簡便な染色法や、高感度な銀染色法などが用いられています。高感度検出の場合は、実験器具の徹底的な洗浄などの厳密な実験操作や、特別な実験施設・装置が必要な場合もあります(表2)。
|
|||||||||||||||||||||||||||||||||||
© 2026 Cytiva