第2章
サンプルの採取、安定化およびタンパク質抽出(6)
抽出例(1)
ほ乳動物培養細胞からのタンパク質の抽出
ほ乳動物細胞には細胞壁がないため、さまざまな方法で容易に溶解できます。ほ乳動物培養細胞の大半は弱い界面活性剤で簡単に溶解できます(前回の記事を参照してください)。穏和な条件が必要な場合(例:タンパク質の構造の完全性または生物学的活性を維持するため)には、Nonidet P-40または同等の界面活性剤を溶解バッファーに添加する必要があります。Nonidet P-40には、染色体DNAが遊離せず細胞質タンパク質と核タンパク質のみが遊離する利点があります。染色体DNAは粘性があるため、タンパク質の調製と分析の過程で障害となる可能性があります。
構造の完全性または生物学的活性を維持する必要がない場合には、より厳しい溶解条件が使用できます(例:放射性免疫沈降アッセイ[RIPA]用溶解バッファーなど)。
Mammalian Protein Extraction Bufferの使用
ほ乳動物培養細胞からタンパク質を抽出するために市販製品を使用できます。弊社の製品の中ではMammalian Protein Extraction Bufferが該当します。
Mammalian Protein Extraction Bufferは、弱い非イオン性界面活性剤を使用したバッファーをベースとしており、タンパク質の抽出を促進し安定性を強化するようにさまざまな塩と添加剤を独自に組合せたものです。使用する手法によってはキレート剤、還元剤、プロテアーゼ阻害剤など他の添加剤や(プロテアーゼ阻害剤を参照してください)Nuclease Mixを添加できます(第4章で記述します)。
Mammalian Protein Extraction Bufferは浮遊細胞にも接着細胞にも使用できます。このバッファーは、酵素アッセイ、さまざまなクロマトグラフィープロトコール、電気泳動など大半の分析手法に適合します。さらに調製後のタンパク質は、レポーター遺伝子アッセイ(例:β-ガラクトシダーゼ、ルシフェラーゼ、クロラムフェニコールアセチルトランスフェラーゼアッセイ)、キナーゼアッセイ(例:タンパク質キナーゼC[PKC]、タンパク質キナーゼA[PKA]、チロシンキナーゼアッセイ)、イムノアッセイ(例:ELISA、ウエスタンブロッティング、ラジオイムノアッセイ[RIA])を含む酵素アッセイに使用できます。プロトコールの要約を以下に示します。詳細については製品使用説明書を参照してください。
材料
製品に付属のMammalian Protein Extraction Buffer 500 ml
PBS
冷却遠心機
前調製
分析手法によってはDTTとEDTAを使用します。使用に適した容量のMammalian Protein Extraction Bufferを、最終濃度が5 mMとなるように必要な場合は、DTTおよびEDTAを添加して調製します。分析手法にかかわらず、二価の金属イオンが必要な場合には、EDTAではなく他の適切な二価塩を最終濃度5 mMとなるように添加してください。
プロテアーゼ活性の阻害が必要な場合には、プロテアーゼ阻害剤カクテルを添加して抽出時のプロテアーゼ活性を抑えます(プロテアーゼ阻害剤を参照してください)。
プロトコール
- 細胞の採取
細胞懸濁液の場合:遠心分離して細胞をペレットにします。
接着細胞の場合:細胞をこすり落とすか剥がした後にペレットにするか、培養プレートに対してステップ2~4を実施します。
- 細胞ペレットの洗浄
細胞ペレットを5~10 mlのPBSで洗浄します。残存する培地を洗い流します。
- 細胞ペレットの再懸濁
Mammalian Protein Extraction Bufferを加え、細胞ペレットを懸濁します。
- タンパク質の抽出
氷上で15~30分インキュベートします。この操作で可溶化平衡に到達させます。
溶解には凍結融解ステップは必要ありません。ただし、1回~2回の凍結融解サイクルであれば細胞抽出に悪影響を及ぼさず、完全に溶解できる場合があります。
- 抽出されたタンパク質を回収します。
冷却遠心機を使用し、高速(例:> 10,000 × g)で30分間遠心分離します。透明な上清を採取し次の処理と分析に使用します。可溶化したタンパク質はこの上清中に回収されます。
細胞片には核および膜に結合したタンパク質が含まれていることがあります。他の界面活性剤を使用すれば、このようなタンパク質も抽出できる場合があります。
Mammalian Protein Extraction Bufferを使用することで、タンパク質の活性を保持しながら、高い収量と再現性で効率的なタンパク質抽出を行えます(図2.3)。この図はCHO細胞からMammalian Protein Extraction Bufferを使用して抽出した溶解液の炭酸脱水酵素活性測定値を、RIPAバッファーを用いて調製した溶解液と比較したものです。どちらの方法でも高いタンパク質活性が保持されたことを示しています。
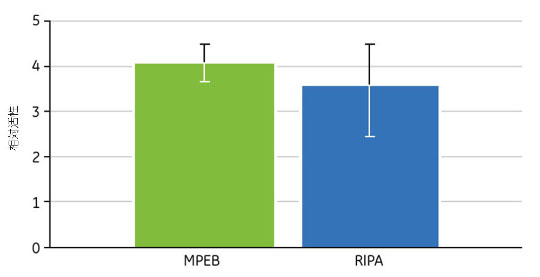
図2.3 Mammalian Protein Extraction Buffer(MPEB)または自家製RIPAバッファー(50 mM Tris-HCl pH 7.5、150 mM NaCl、1% NP-40および0.1% デオキシコール酸ナトリウム)を使用して調製したCHO細胞抽出液中の炭酸脱水酵素活性を測定しました。サンプル濃度の違いを補正して、相対活性を計算し、その結果の平均値と標準偏差を示します。
>>抽出例(2)
タンパク質サンプル調製ハンドブック目次 |2章 References | 略号と用語、記号解説

