第4章
タンパク質サンプル調製ワークフロー内での適合性の確保(4)
バッファー交換と脱塩(4)
■沈殿
沈殿は試薬添加後の溶解度の変化によって生じます。沈殿物は遠心分離またはろ過で回収した後、洗浄または可溶化します。目的タンパク質を選択的に沈殿させ、夾雑物は沈殿させない試薬を使用すると、再可溶化後にクリーンアップ効果と濃縮効果を得られます。適用範囲が広い試薬は、硫酸アンモニウム、PEG、TCAなどです。
よく使用される沈殿法は、過酷な温度、pHおよび塩濃度条件を用いる方法や、有機溶媒を添加する方法です。タンパク質を脱水和し(可逆的に)沈殿させるためにアセトンが使用されることがあります。脂質は、アセトン/水混合液中で溶解性を保つため、沈殿したタンパク質から洗い落とせます。有機溶媒法の欠点は、きわめて疎水性が強い一部のタンパク質(膜タンパク質)は、このプロセスで溶解して失われる可能性があることです。より汎用的な沈殿法はTCAとアセトンを組合わせて使用するもので、この方法は植物からのタンパク質の抽出などさまざまなプロトコールに組込まれています2。
SDS-PAGE Clean-Up Kitを使用したSDS-PAGEサンプルの調製
CytivaのSDS-PAGE Clean-Up Kitを使用すると、SDS-PAGE分析用のタンパク質の選択的沈殿を迅速かつ定量的に行えます。このキットは、SDS-PAGE分析でよく見られる以下のような問題を解決する手段として特に有用です。
- タンパク質濃度が低すぎる
- 塩濃度が高すぎる
- 脂質、核酸およびフェノール類が干渉する
- バンドが広がる
タンパク質濃度が低いとシグナルが弱くなり、バンドの検出が難しくなります。サンプル中の塩濃度が高いと電気泳動開始時の電気伝導度の勾配が顕著になり、バンドの歪み、屈曲、変形などのアーチファクトが生じる可能性があります。ゲルレーン間の塩濃度の違いはバンドの広がりにもつながります。また、サンプル中の親油性物質によりバンドの汚れやテーリングが生じることがあります。
SDS-PAGE Clean-Up Kitでサンプルを処理すると、SDS-PAGEのデータの質を改善でき、レーンの変形が減り、分離能が向上し、「発表にふさわしい品質」の電気泳動データが得られます。このキットを使用すると、他の方法ではバンドが汚いあるいは、薄すぎたりするサンプルでもSDS-PAGEを効率的に行えます。SDS-PAGE Clean-Up Kitの手順では、沈殿剤と共沈剤を組合せて使用し、サンプル中のタンパク質を定量的に沈殿させます。沈殿したタンパク質を遠心分離でペレット化し、沈殿物を洗って非タンパク質夾雑物をさらに除去します。タンパク質混合物を再度遠心分離し、得られたペレットを再懸濁した後、SDS-PAGEサンプルバッファーと混合して加熱し、SDSゲルにアプライします。
濃縮タンパク質サンプルは、1 ng/mlといった低濃度サンプルの供給源からも調製できます。回収率は一般に90%以上です。SDS-PAGE Clean-Up Kitを使用する前に、遠心分離などを使用し、サンプルに粒子状物質がほとんど含まれていない状態にしてください。
材料
キットに付属の沈殿剤、共沈剤、洗浄バッファー、洗浄添加剤、バッファーI、バッファーIIおよびSDS-PAGEサンプルバッファー
微量遠心機
95ºC~100ºCのヒートブロックセット
ボルテックスミキサー
前調製
必要に応じて10,000 × gで10分間遠心分離して粒子状物質を除去します。
洗浄バッファーを1時間以上-20ºCに冷却します。
還元剤をSDS-PAGEサンプルバッファーに加えます(100 μl当りDTT 3.1 mgまたはβ-メルカプトエタノール5 μl)。
プロトコール1
- タンパク質の沈殿
沈殿剤を加えます。ボルテックスし、氷上で15分間インキュベートします。共沈剤を加え混合します。
- タンパク質のペレット化
12,000 × gで5分間遠心分離し、上清を捨てます。
- ペレットの拡散
水を加えてボルテックスします。
- 洗浄
冷却した洗浄バッファーと洗浄添加剤を加えます。10分ごとにボルテックスしながら30分間インキュベートし、夾雑物を除去します。
- タンパク質のペレット化と乾燥
12,000 × gで5分間遠心分離し、上清を捨てます。チューブを反転させ乾燥させます。
- ペレットの再懸濁
バッファーIを加えます。ボルテックスし、氷上で5分間インキュベートします。
- pHの調節
バッファーIIを加えます。ボルテックスし、氷上で5~10分間インキュベートします。
- アプライ用サンプル調製
還元剤を添加したSDSサンプルバッファーを加えます。ボルテックスし、5~10分間インキュベートします。
- 加熱によるタンパク質変性
95ºC~100ºCで3分間インキュベートします。
- SDS-PAGEゲルにサンプルをアプライします。
1 1~100 μgのタンパク質を含む1~100 μlのサンプル用のプロトコールです。これよりも量が多いサンプルについては、製品使用説明書を参照してください。
2-D Clean-Up Kitを使用した二次元電気泳動/DIGEサンプルの調製
タンパク質沈殿に現在使用されている方法には、以下に示すように二次元電気泳動における重大な欠点がいくつかあります。
- 沈殿が不完全であるとサンプルからタンパク質が失われ、二次元分析の結果にバイアスがかかる。
- 沈殿したタンパク質の再懸濁が困難な場合があり、完全には回収できないことが多い。
- 沈殿手順自体により、一次元目等電点電気泳動に干渉するイオンが混入する可能性がある。
- 沈殿には時間がかかることがあり、サンプルを一晩インキュベートしなければならないことがある。
Cytivaの2-D Clean-Up Kitは、これらの欠点を回避しながら二次元電気泳動で分析するタンパク質を選択的に沈殿させることができます。タンパク質の可溶化に広く使用されている界面活性剤やカオトロープなどの試薬による干渉を引き起こすことなく、さまざまなサンプル供給源からタンパク質を定量的に沈殿させることができます。回収率は一般に90%以上です。この手順では、未処理サンプルと比較して、スポット数の増減やスポット位置の変化は生じません。沈殿したタンパク質は2-Dサンプルバッファーで容易に再懸濁できます。この手順は1時間以内に操作が完了します。
2-D Clean-Up Kitでサンプルを処理すると、二次元電気泳動のデータの質を改善でき、縦や横のストリーキングやバックグラウンドの汚れなど、干渉夾雑物による影響が低減します。このキットを使用すれば、他の方法ではバンドが汚なすぎたり薄すぎるサンプルでも、二次元分析を効率的に行えます。
2-D Clean-Up Kitの手順では、沈殿剤と共沈剤を組合わせて使用し、サンプル中のタンパク質を定量的に沈殿させます。遠心分離でタンパク質をペレット化し、沈殿物を洗って非タンパク質夾雑物を除去します。このタンパク質混合物を再度遠心分離して得られたペレットは、適切な二次元分析サンプルバッファーに容易に再懸濁できます。
材料
キットに付属の沈殿剤、共沈剤、洗浄バッファーおよび洗浄添加剤
微量遠心機
ボルテックス
再懸濁に使用する膨潤液またはサンプルバッファー1
前調製
タンパク質サンプルから微粒子状物質が実質的に除去されている必要があります。必要に応じて遠心分離で清澄化します(上記を参照してください)。
洗浄バッファーを1時間以上-20ºCで冷却します。
1 表4.3に適切なバッファーの例を示します。
プロトコール2
- タンパク質の沈殿
沈殿剤を加えます。ボルテックスし、氷上で15分間インキュベートします。共沈剤を加え混合します。
- タンパク質のペレット化
12,000 × gで5分間遠心分離し、上清を捨てます。
- ペレットの洗浄
ペレットの上に共沈剤を加え、氷上で5分間インキュベートします。
- タンパク質のペレット化
12,000 × gで5分間遠心分離します。上清を捨てます。
- ペレットの懸濁
ペレットに水を加えます。ボルテックスし、氷上で5分間インキュベートします。
- 洗浄
冷却した洗浄バッファーと洗浄添加剤を加えます。10分ごとにボルテックスしながら30分間インキュベートし、夾雑物を除去します。
- タンパク質のペレット化と乾燥
12,000 × gで5分間遠心分離し、上清を捨てます。チューブを反転させ乾燥させます。
- ペレットの再懸濁
適切な膨潤液またはサンプルバッファーにペレットを再懸濁させます。
- サンプルを一次元目IEFゲルにアプライする準備ができました。
2 1~100 μgのタンパク質を含む1~100 μlのサンプル用のプロトコールです。これよりも量が多いサンプルについては、製品使用説明書を参照してください。
表4.3 膨潤液/IEFサンプルローディングバッファーの例
| 8 M ureaを含む膨潤液 |
| (8 M urea, 2% CHAPS, 40 mM DTT, 0.5% Pharmalyte™ or IPG buffer, 0.002% BPB (bromophenol blue), 2.5 ml) これはすべての目的できれいでシャープな二次元展開をするのに適した溶液です。 |
| | Final concentration | Amount |
| Urea (FW 60.06) |
8 M |
1.20 g |
| CHAPS1 |
2% (w/v) |
50 mg |
| Carrier ampholyte2 (Pharmalyte™ or IPG Buffer) |
0.5% (v/v)3 |
12.5 µl |
| DTT (FW 154.2) |
40 mM |
15.4 mg |
| Bromophenol Blue |
0.002% (w/v) |
5 µl of a 1% (w/v) solution |
| Distilled or deionized water |
to 2.5 ml |
| 7 M urea / 2 M thioureaを含む膨潤液 |
(7 M urea, 2 M thiourea, 4% CHAPS, 40 mM DTT, 0.5% Pharmalyte™ or IPG buffer, 0.002% bromophenol blue, 2.5 ml)
これはより強く可溶化するための溶液で、2Dパターンのスポットがより多く得られます。しかし、上記溶液よりもシャープさが失われる可能性があり、より横のストリーキングが入りやすくなります。 |
| Urea (FW 60.06) |
7 M |
1.05 g |
| Thiourea (FW 76.12) |
2 M |
381 mg |
| CHAPS1 |
4% (w/v) |
100 mg |
| Carrier ampholyte2 (Pharmalyte™ or IPG Buffer) |
0.5% (v/v)3 |
12.5 µl |
| DTT (FW 154.2) |
40 mM |
15.4 mg |
| Bromophenol Blue |
0.002% (w/v) |
5 µl of a 1% (w/v) solution |
| Distilled or deionized water |
to 2.5 ml |
1 他の非イオン性もしくは両イオン性の界面活性剤を使用できます。例えば、TritonX-100, NP-40, octyl glucoside and the alkylamidosulfobetainedetergents ASB-14 and ASB-16.
2 IPGバッファーもしくはファルマライトは使用するIEFゲルのレンジに合わせて使用します。
3 いくつかのアプリケーションで0.5%以上の濃度で使用する場合があります。
2-D Clean-Up Kitを使用してサンプルを調製した場合、タンパク質分離の全体的な質が全細胞抽出液またはアセトン沈殿処理したサンプルに比べ向上しました。縦のストリーキングが少なかったことから、ストリップからゲルへのタンパク質移行が改善されたと考えられます(図4.6)。いずれの方法でもタンパク質泳動パターンの変形や他の重大な変化は認められませんでしたが、2-D Clean-Up Kitでサンプルを調製した場合にはスポット分離が明瞭になり、スポット数が多くなりました(図4.6C)。2-D Clean-Up Kitで調製したサンプルからは801のタンパク質スポットが得られたのに対し、アセトン沈殿法で調製したサンプルおよび全細胞抽出液から得られたスポットの数はそれぞれ758、726でした。このように、2-D Clean-Up Kitを使用することで二次元電気泳動のタンパク質分離能と回収率が改善されました。
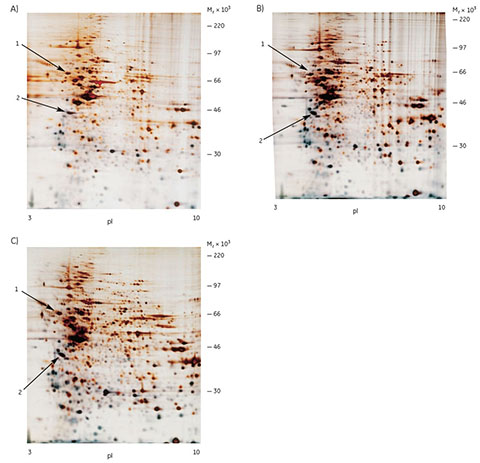
図4.6 (A)全細胞抽出液、(B)アセトン沈殿処理した抽出液、(C)Clean-Up Kitで処理した抽出液を用いて作成したMCF7細胞プロテオームマップ。すべてのゲルに50 μgのタンパク質をアプライしました。一次元目電気泳動のpH勾配をゲルの下に示します。二次元目SDS-PAGEにおける分子量マーカーの移動位置は、ゲルの横に分子量範囲として示します。MS分析に使用するタンパク質の移動位置を矢印で示します。データは参考文献3のものです。
■固相抽出(SPE)
固相抽出は吸着クロマトグラフィーと同等の方法ですが、その目的は分子クラスを分離することです。この手法は一般にバッチで行うため、固相の種類とそれを保持するために使用するデバイスの種類が、クロマトグラフィーカラムとは異なることがあります。SPEでは、既知のリガンド結合特性による固相への選択的な結合に基づいてタンパク質の濃縮や夾雑物の除去を行います。すなわち、タンパク質を結合させて夾雑物を洗い流すか、夾雑物を結合させてタンパク質を直接回収します。リガンドには通常のクロマトグラフィー(IEX、RPCおよびHIC)に使用される選択的リガンドを変化させたものや、特定の夾雑物を除去するために特別に設計されたものがあります(例:セラミックハイドロキシアパタイトによるSDSの除去4)。
>>サンプルクリーンアップ、サンプル濃縮/容積低減
タンパク質サンプル調製ハンドブック目次 |4章 References|略号と用語、記号解説


