高品質なサンプル調製が研究を左右する
近年、がん研究や再生医療の分野で、オルガノイドやスフェロイド、ティシュエンジニアリング、マイクロ生理学的システム(MPS)といった三次元(3D)細胞モデルが急速に広がっています。これらの3Dモデルは、従来の2D培養系や動物モデルよりも組織の複雑性や腫瘍微小環境をよく再現できるため、疾患モデルや薬剤評価に非常に有用です。しかしこれらの3D組織はそのままではシングルセル解析や遺伝子発現解析に適用できません。ここで重要になるのが「組織分散」というプロセスです。
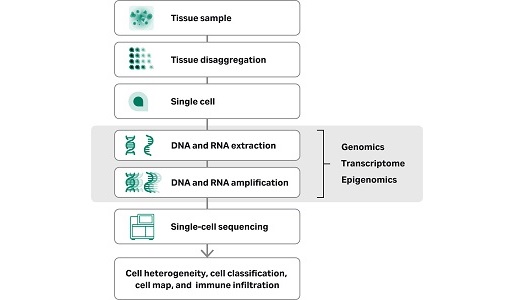
組織分散(tissue dissociation)とは、生体組織に限らず、CDX(細胞株由来異種移植モデル)やPDX(患者由来異種移植モデル)を含む複雑な組織を、酵素処理や機械的手法でバラバラにして単一細胞の懸濁液を作る工程です。なぜこれが重要なのでしょうか?理由はシンプルです。サンプル調製の質 が、ダウンストリームの解析結果を左右するからです。
例えば、single-cell RNA-seqのような高精度な解析では、最終的なデータ品質を決める要素として、細胞の生存率やRNAの完全性が極めて重要です。実際、組織採取から細胞解離に至るまでの条件(温度、機械的手法、時間、酵素など)は、下流のトランスクリプトーム解析に大きな影響を与えます。
たとえば、解離処理が過度に長いと細胞の生存率が低下し、逆に短すぎると回収細胞数が不足することがあります。適切な条件設定で効率よく細胞を解離しつつ、細胞損傷、バイアス、ストレスシグナルの発現を最小限に抑えることが、信頼性の高い単一細胞解析には欠かせません。だからこそ、適切な組織分散は研究の成功に直結する極めて重要なステップなのです。
組織分散には、酵素処理を行い、ハサミなどで組織をミンスするマニュアル操作があります。条件を細かく調整できる柔軟性は魅力ですが、再現性や作業負担の課題も残ります。
一方で、近年は機械を使用して作業負担を減らし、再現性を高める方法も登場しています。こうした自動化ソリューションは、ヒューマンエラーを減らし、スループットを向上させることが可能です。特にsingle-cell RNA-seqや高精度な遺伝子解析を行う場合、こうしたアプローチは結果の信頼性を大きく高めます。
本ページでは組織分散にフォーカスし、関連情報やソリューションのご紹介を行います。
注目のコンテンツ
-
シングルセルRNA-seqと低温組織解離
scRNA-seqの精度には組織解離が重要です。低温解離は転写アーチファクトを減らし実際の状態を反映しやすいが、効率や冷ショックが課題。酵素改良で改善が期待されます。
-
心臓組織からの高品質シングルセル懸濁液
心臓組織から高品質なシングルセル懸濁液を得るには、効率的な解離が重要です。VIA Extractorを用いることで高い生存率と均一性を確保し、scRNA-seqに適した品質を実現できます。
-
シングルセルRNAシーケンスのための高品質細胞分散
VIA Extractorは新鮮および凍結組織を効率的に単一核懸濁液へ解離し、RNAシーケンスの精度を高めます。標準化されたプロセスで細胞の完全性と再現性を確保できます。
-
シングルセル実験成功のための組織分散ツールを学ぶ
低温で組織を分散することで転写アーティファクトが軽減され、トランスクリプトームがより正確に保持されます。以上を踏まえ、本ウェビナーでは弊社製品を使用した分散ツールと事例をご紹介します。
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。