キャプチャー法は現在のBiacore™の測定における主流の方法です。従来の直接法と比べてアッセイ系構築にかかる時間が短縮されるメリットはとても大きいです。誰もがReference cellとActive cellのキャプチャー分子の量を揃えなければ…と思うはずです。これは正しそうですが仮にバラついていたらダメなのでしょうか?
まずはキャプチャー法のおさらいから
Reference cellはリガンドがない以外はActive cellと同じにする
ほぼこのタイトル通りなのですが、Ref cellとAct cellの違いは基本的には*リガンドの有無だけです。すなわち、キャプチャー分子は固定化する必要があります。
例を見てみましょう。Biotin CAPture Kitの場合は以下のようになります(Fc1がRef cell、Fc2がAct cellです)。
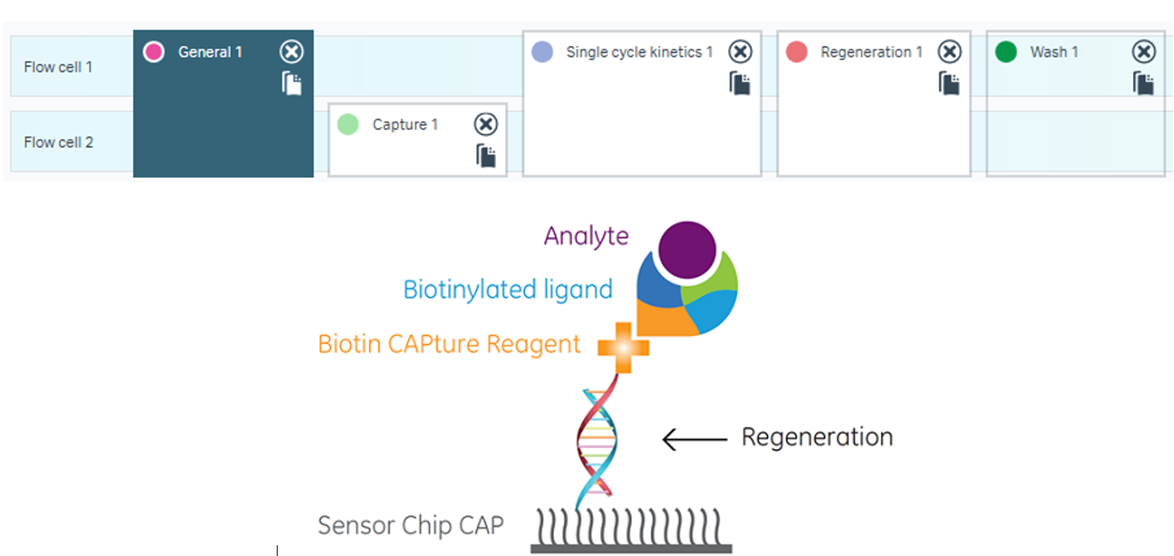
表1.各種検出方法と特徴
| General 1 | Ref, Act cellにBiotin CAPture Reagentを添加します。 |
|---|---|
| Capture 1 | Act cellだけにBiotinylated ligandが添加されます。 |
| Single cycle kinetics 1 | Ref, Act cellにAnalyteが添加されます。 |
| Regeneration 1 | Ref, Act cellに再生溶液が添加され、一本鎖オリゴDNAだけになります。 |
| Wash 1 | Bufferにより流路が洗浄されます。 |
Human Antibody Capture Kitなどの場合は、Amine couplingにてあらかじめRef, Act cellに抗ヒト抗体を固定化してからAct cellにだけヒト抗体を添加、Ref, Act cellにAnalyteを添加、続いてRegeneration溶液を添加…のようになります。
他にもSensor Chip Protein Aの場合はプレイモビライズされているため自分でキャプチャー分子を固定化はしませんが、やはりキャプチャー分子はRef cellにも固定化されていることが分かります。
*例外としてSensor Chip NTAとNTA Reagent Kitを使用した場合があります。Ref cellにはNi solutionを添加しません。
なぜ??
Ref cellの役割を考えてみると解決します。Biacoreで見られるレスポンスは以下のようなものが考えられます。
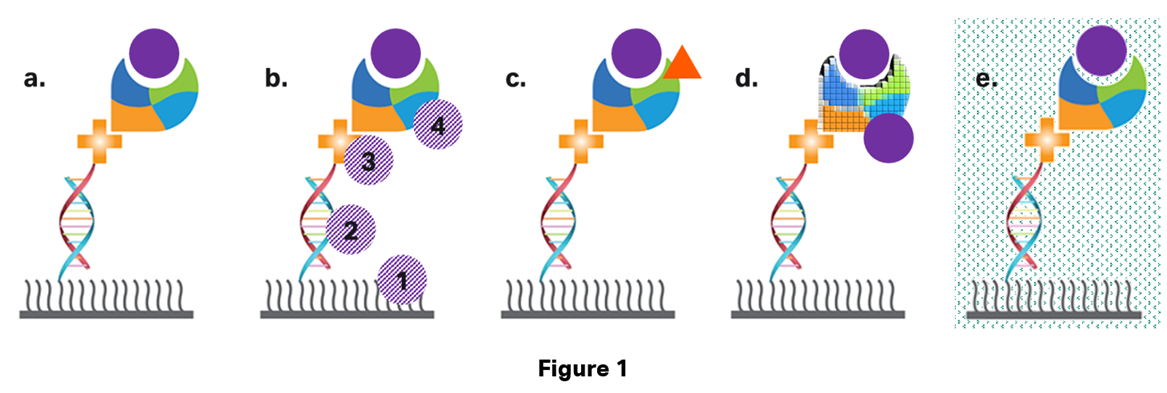
a.は理想的な形です。アナライトがリガンドの望ましいポケットにのみ結合し、特異的な結合のみが起きています。Biacore™の測定ではa.のようになるよう、リガンドやアナライトの物性、ランニング緩衝液組成などに気を配る必要があります。しかし現実的には今得られたレスポンスがa.の状況かどうかを判断することはできません。
b.の状況は、アナライト自体がそれぞれ想定とは異なる場所に結合(吸着、あるいは接近)しています。1は金膜かデキストラン自体、あるいはデキストランの負電荷、2は一本鎖オリゴDNA、3はBiotin CAPture Reagent(大体の場合SA)、4はリガンドの望ましいポケット以外の場所に結合してしまうパターンです。
これらはいわゆる「非特異的な結合」です。4に関してはある意味特異的な結合であり、unwantedな結合と考えられます。これらの非特異的結合の除去方法に関してはこちらの「天敵「ノンスぺ」の見つけ方・退治法」記事をご参照ください。非特異的結合は「どれだけ高濃度のアナライトを添加してもレスポンスが収束しない」という特徴がありますので目安にしてください。
c.の状況は不純物が混じっていたパターンで、これは分かりやすいですね。アナライト側のサンプルの問題ですので十分に精製してください。全く違うものが混じるパターンもありますが、フラグメント化したものや逆に凝集してしまったアナライトが混じることもあります。
d.の状況はリガンド側の物性が問題になる状況です。Biotin CAPture Kitの場合はリガンドをマイルドな条件でチップ表面上に保持できるため問題になることは少ないですが、それでもリガンドが低精製度だったり保存状態が悪い場合があります。Amine couplingの場合はプレコンセントレーション効果を得るためにリガンドを酸性条件に曝す必要がありますが、これにより変性・失活する可能性が考えられます。
e.はランニング緩衝液とは異なる組成の溶液が流れていることを表現してみました。ご承知の通りBiacore™は屈折率の変化を読み取る装置ですので、ランニング緩衝液とは異なる組成の溶液が添加されると、結合とは異なるレスポンス(溶液効果、Bulk)が発生します。アナライトを添加する際にランニング緩衝液で希釈して添加することが多いと思いますが、どうしてもストック溶液からの持ち込み分が存在しますから溶液効果をゼロにすることは不可能です。
さて話をRef cellにキャプチャー分子を置く理由に戻してみます。b.の1~3の状況ではRef cellにも同じように非特異的結合が起きているものと考えられますので、Act – Ref の計算をすることで「ある程度は」差し引くことが可能です**。ただ、b.4については、上述の通りある意味これは特異的な結合ですから差し引きはできません。
**非特異的な結合のレスポンスの大きさがRef cellとAct cellで全く同じように起きているとは限りませんから、本当の意味では正確にはなりません。とは言えこれまた完全にゼロにすることは難しいでしょうから、少しは非特異的結合が乗っていても許容する、という意味です。本社が提供しているYoutubeの資料ではシグナルの5%以下程度の非特異的結合であれば許容することが述べられています。
c.,d.に関してはアナライトやリガンド自体の物理的な特性(疎水性、電荷など)を再度見直してもらうほかありません。
e.に関しては溶液効果の大きさがRef cellとAct cellで同じであれば差し引くことができます。溶液効果の大きさはアナライトのストック溶液の金膜付近における存在量で決まるわけですが、これは金膜表面に存在する分子の体積分だけ排除されています。Act cellには必ずリガンド分子がありますから、リガンド分子の体積分だけ溶液効果の大きさはRef cellに比べて小さくなります。したがってRef cellとAct cellの溶液効果の差はゼロにはできません。しかし水系のバッファーであればRef cellとAct cellでほとんど溶液効果の差がないことや、有機溶媒が用いられたバッファーの場合はかなりリガンド分子の体積分の溶液効果が大きく出てしまうものの、溶媒補正を用いることで差し引きが可能なため、コントロール可能なズレであると言えそうです。
結論
まとめると、Ref cellへの非特異的結合が共用範囲内にならなかったときの原因特定のために、リガンドの有無以外の環境はRef cellとAct cellで揃えるという考えで基本的に良いです。逆に言いますと、Ref cellへの非特異的結合が許容範囲内であることが確認されているのであれば、それほど頑張ってRef cellとAct cellのキャプチャー分子の固定化量を揃える必要はない、と言えそうです。意外な結論で驚かれたのではないでしょうか?ぜひあるある失敗例「フィッティングがかからない!:リファレンスへの非特異結合編」もご参照ください。