|
||
|---|---|---|
|
|
||
|
Location:Home > テクニカル情報配信サービス > Pure Protein Club |
||
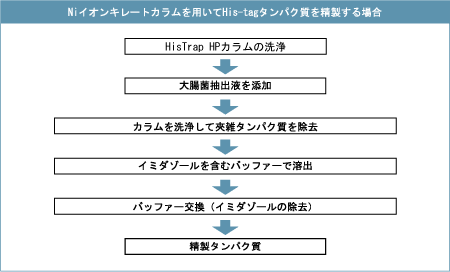
組換えタンパク質の精製戦略目的のタンパク質を融合タンパク質として発現させることにより、精製および検出が容易になります。融合タンパク質の精製では、融合したタグ部分と基質との親和性を利用したアフィニティークロマトグラフィーが一般的に用いられます。ここでは、クロマトグラフィーの基礎とともに、最も多く利用されているGST融合タンパク質とHis-tagタンパク質の精製方法を紹介します。 1) クロマトグラフィーとは His-tagタンパク質とはHis-tagタンパク質(Histidine tagged Protein)は、アフィニティー精製のためにヒスチジン6~10残基を含む短いペプチドを末端*に付加したタンパク質です。ヒスチジンのイミダゾール環にはニッケルやコバルトイオンと強く結合する性質があるため、His-tagタンパク質はこれらの金属イオンを結合したクロマトグラフィー担体を用いて容易に回収・精製することができます。さまざまな発現ベクターが市販されているためプラスミド構築も容易であり、組換えタンパク質の発現・精製法として広く活用されています。 *アミノ末端・カルボキシル末端のいずれかに付加するのが一般的ですが、両端に付加する場合もあります。 His-tagタンパク質の特徴His-tagタンパク質の特徴は、His-tag部分の配列が単純で分子量が小さい点にあります。このため、(1)目的タンパク質の立体構造への影響が少ない(2)His-tag部分の立体構造に変化がないため、アフィニティー精製時に変性剤を加えても回収効率への影響が小さい(3)タグ部分は免疫原性をほとんど示さないなどといった利点があります。ただし、タンパク質の種類や実験の目的によっては、His-tag部分が予想外の影響をおよぼすことがあります。その場合はプロテアーゼ認識部位を組み込んで、精製後にHis-tag部分を目的タンパク質から除去できるようにするなどの工夫が必要です。 His-tagタンパク質の精製発現したHis-tagタンパク質は、ニッケルイオンを配位結合した金属キレートアフィニティーカラムを利用して高純度に精製することができます。カラムに結合させた後、イミダゾールを添加するとHis-tagのヒスチジン残基のイミダゾール環と拮抗的に作用して、His-tagがニッケルイオンから解離し、His-tagタンパク質がカラムから溶出されます。 ■His-tagタンパク質精製前のバッファー交換昆虫細胞、ほ乳類培養細胞で発現させたHis-tagタンパク質の場合は、培地成分にキレート作用を持つ物質(EDTA、EGTA、クエン酸など)が含まれる場合があり、金属キレートアフィニティークロマトグラフィーへの吸着阻害作用が考えられます。このようなサンプルは、限外ろ過や透析、脱塩カラムでキレート剤を除去するか、イオン交換カラムで精製してからNi固定化カラムで精製してください。培養細胞上清のように、目的タンパク質の濃度が低く、液量が大量にある場合には、限外ろ過でキレート作用を持つ物質の除去とサンプルの濃縮が可能です。また初期精製としてイオン交換クロマトグラフィーを行うと、精製全体でかかる時間の短縮ができます。細胞培養後の清澄化培養上清を、バッファー交換なしでそのまま添加可能なクロマトグラフィー担体はこちら 実際の操作は以下に示す流れにしたがって行います。バッチ法でサンプルの清澄化ステップを省略することも可能です。
溶出条件の至適化標準的なプロトコールによる精製では、高濃度のイミダゾールを用いてワンステップでHis-tagタンパク質を溶出しますが、それで十分な純度が得られない場合は、ステップワイズもしくはグラジエント溶出の予備実験によって最適なイミダゾール濃度を調べます。なお、大腸菌由来タンパク質の混入は、サンプルの添加時に用いる結合バッファーに低濃度(20~40 mM)のイミダゾールを添加することで防ぐことができます。 関連情報お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2025 Cytiva