この記事は、自動翻訳ソフトウェアによって翻訳されています。自動翻訳によって生成された記事(Cytivaにより見直された記事を含む)には、単語、構文、文法などの間違いが含まれている場合があります。弊社は、コンテンツの不正確な翻訳またはその使用により生じる間違いや誤解、または損傷に対して責任を負いかねます。あらかじめご了承ください。
By Dr. Tobias Hahn, R&D leader at Cytiva
ウイルス様粒子(VLP)は、新興ウイルスおよび癌を標的としたワクチン開発への使用が期待される分子フォーマットです。VLPは、抗原提示細胞(APC)に容易取り込まれるサイズと形状を有しており、その結果、適応免疫反応が効果的に誘導できます。
VLPはウイルスの構造タンパク質の組換え発現によって形成されます。VLPの大規模生産する方法として、浮遊細胞培養を用いた生産があります。細胞培養上清からVLPを抽出するプロセスは、時間と労力を要します。精製方法の開発は、実験計画法(DoE)に従い、パラメーターを最適化する実験的手法が主流です。マニュアルで選択したプロセスデザイン空間をスクリーニングするには、多くの実験が必要です。
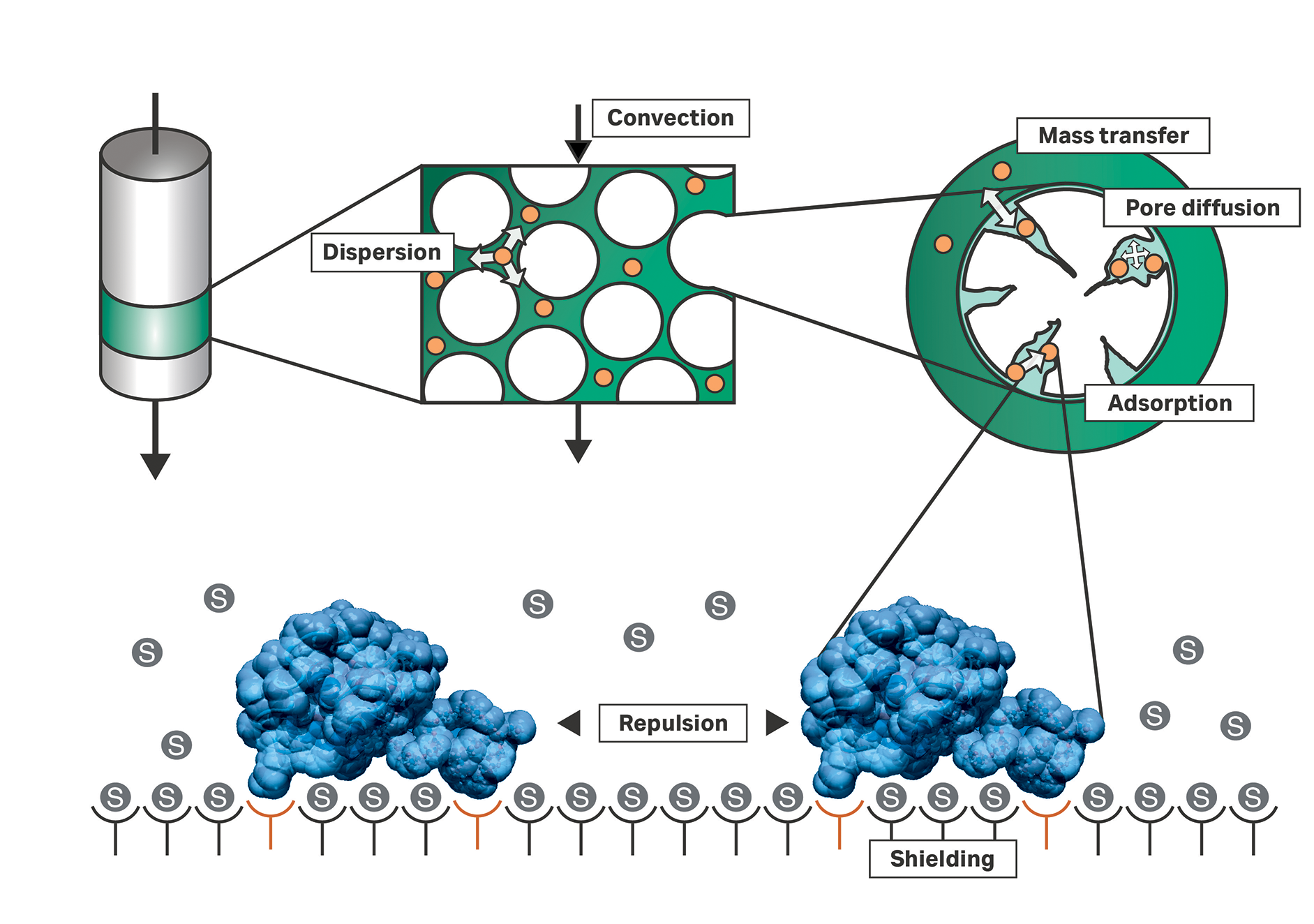
これに対し、メカニスティックモデルは流体原理および熱力学原理を用いてサンプル成分の輸送を記述します(図1)。さらに、メカニスティックモデルを用いると、in silicoで効率的にプロセスの最適化を行うことができます。この記事では、GoSilico™とCEVEC Pharmaceuticalsが行ったVLPの精製プロセス開発の革新的なアプローチの結果を紹介します。
図1. メカニスティックモデルで使用されるクロマトグラフィープロセスの流体力学原理および熱力学原理
材料および方法
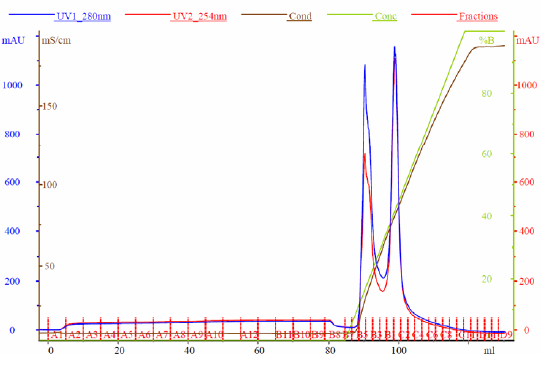
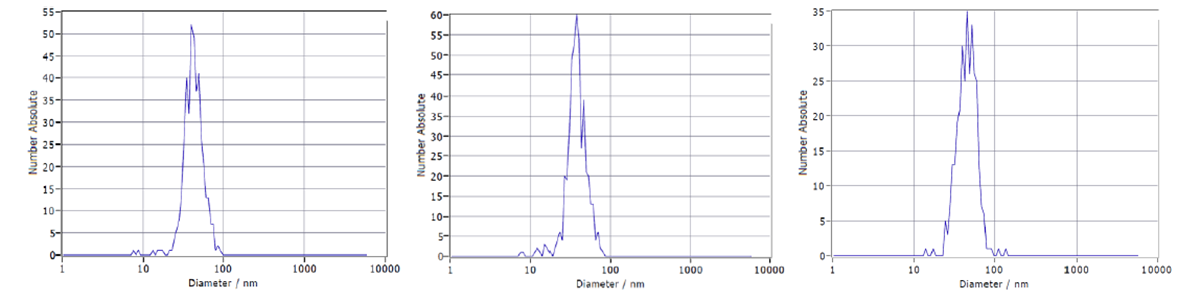
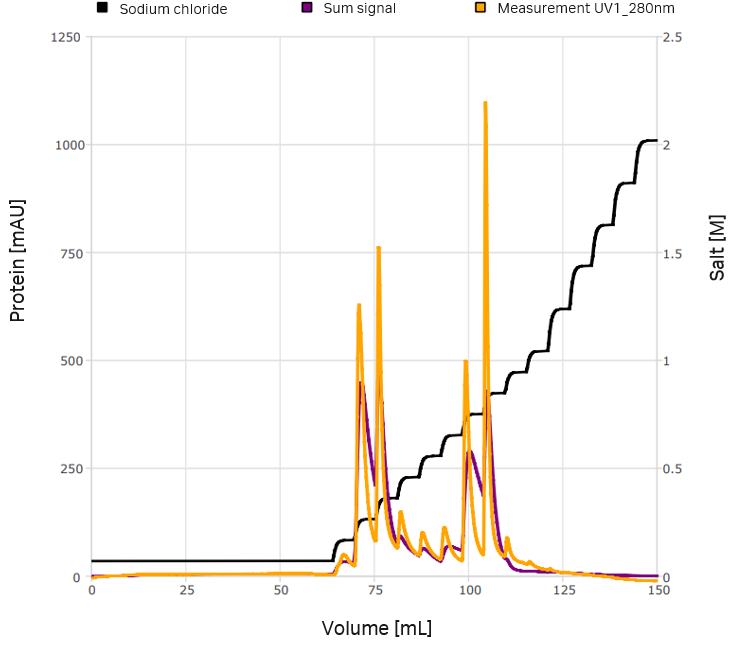
VLPはウイルスの構造タンパク質の組換え発現によって構築されます。VLPの大規模生産する方法として、浮遊細胞培養中での発現があります。CEVECのCAP®Goプラットフォームを使用して、約40 nmのサイズのフラビウイルスVLPを製造しました。最初の精製ステップとして、タンジェンシャルフローフィルトレーションを用いました。分離方法としては陰イオン交換クロマトグラフィーを選択しました。クロマトグラフィー実験は、ÄKTA™システムを用いて実施しました。クロマトグラムおよび追加の分画分析をGoSilico™クロマトグラフィーモデリングソフトウェアにインポートし、モデリングおよび最適化を行いました。クロマトグラムを図2に示します。ナノ粒子トラッキング解析により、2種類のVLP変異体が明らかになりました(図3)。
図2. UNICORN™ソフトウェアからエクスポートされたクロマトグラム
図3. 供給液(左)、第1溶出ピーク(中央)、第2溶出ピーク(右)のナノ粒子追跡解析で、2種類のVLP変異体を示す
モデル校正
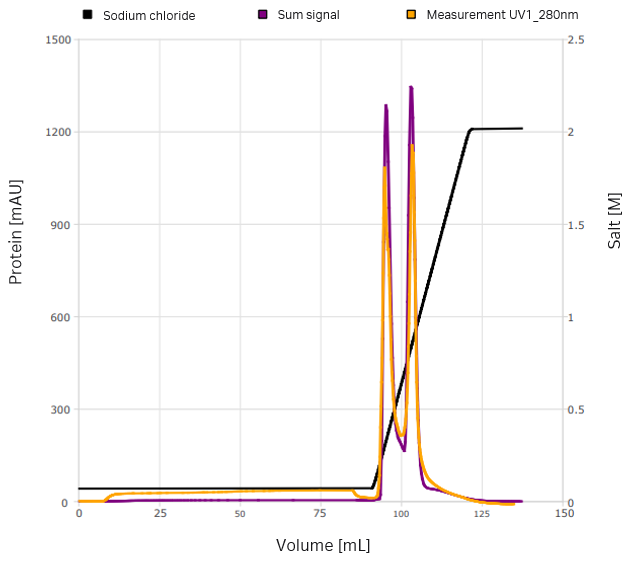
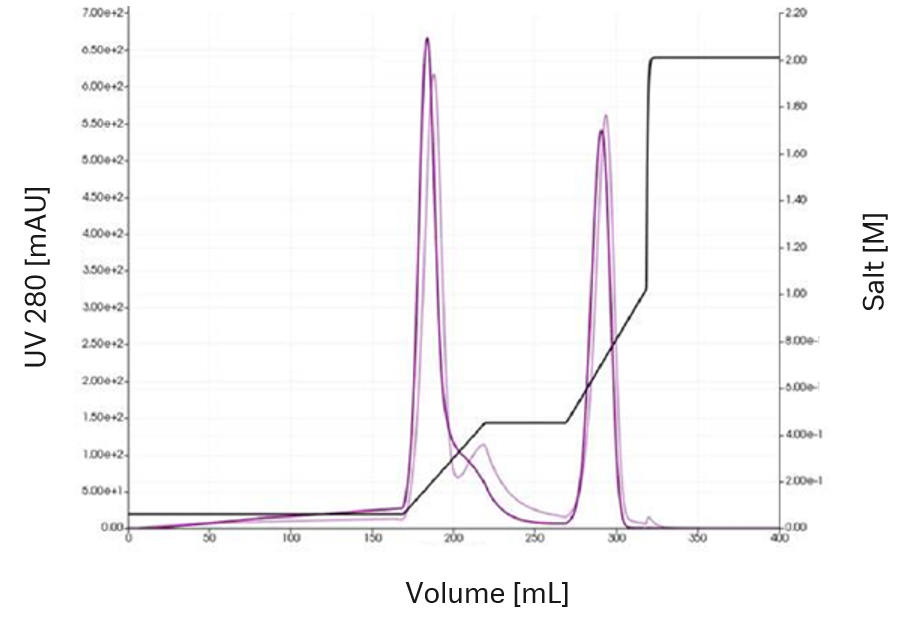
まず、グラジエント溶出とステップ溶出の2つのクロマトグラムのみを記録しました(図4および5)。スペクトル分析のみを用いて、6種類の供給成分を特定しました。イオン交換クロマトグラフィーの立体質量作用(SMA)モデルと共に、ラジアルフローカラムモデルを選択しました。モデルの校正は、GoSilico™クロマトグラフィーモデリングソフトウェアに組み込まれたピーク検出法およびパラメーター推定法を用いて実施しました。不確実性定量化後(以下のモデル品質を参照)、ステップ溶出とグラジエント溶出の組み合わせた最初のin silicoモデルの最適化を行いました。
図4. グラジェント溶出を用いた最初の実験では、2つのVLPピークを確認
図5. ピーク分離に適したレベルを特定するため、段階溶出を実施
モデルベースのプロセス最適化
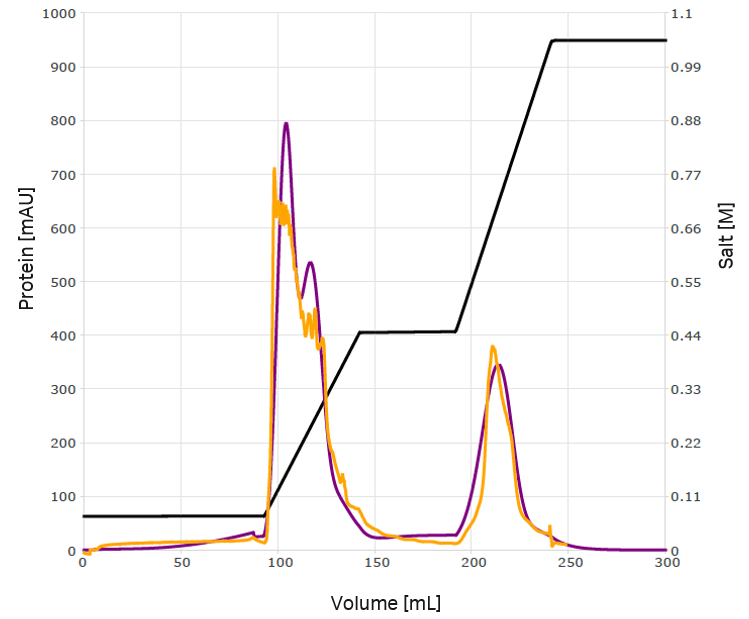
概形のモデルに基づいて堅牢な溶出条件を開発しました。ベースライン分離を目標としながらモデルの品質を向上させるために、最初のステップ溶出をグラジエント溶出に置き換えました(図6)。宿主細胞タンパク質の大部分を除去でき、VLPの95%超を回収できました。さらに、使用した溶出条件で望ましいベースライン分離が得られました。代替法として、第1ピークのフロースルーを検討しました。この設定で検証を行ったところ、モデル予測値と一致しました(図7)。
図6. 堅牢な最適化を実施し、第1ピークの成分4を移行させた。電気伝導度のトレースは黒色で示し、紫色と薄紫色は2通りの最適化シミュレーション結果を示す
図7. 検証はモデルに基づく予測値とよく一致した。電気伝導度のトレースは黒色で示す。シミュレーションの結果を紫色で、検証測定の結果をオレンジ色で示す
モデル品質
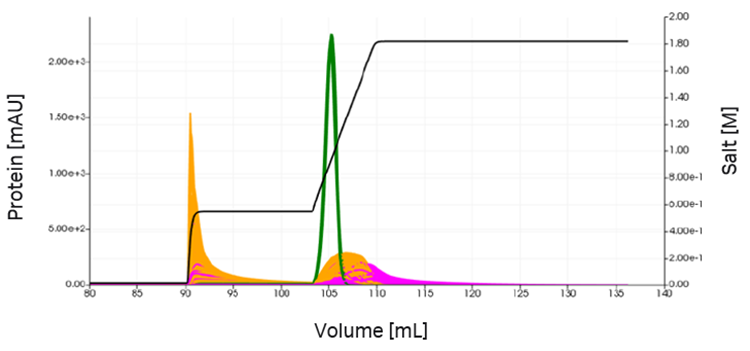
目視検査ではモデル適合度はきわめて良好でしたが、パラメーターが十分に特定されているかについて情報を得るには95%信頼区間を算出する必要があります。目的物質(緑色)の近くに溶出する成分4(オレンジ色)および成分6(ピンク)の推定には不確実性があり、共溶出の可能性があります。1000ポイントのラテン超方格サンプリング法(LHS)で得られたクロマトグラムと収率分布を図9に示します。
図8. 成分4(オレンジ色)および成分6(ピンク色)のモデルパラメーターに不確実性がり、プロセス条件を最適化するとさまざまなクロマトグラムが得られる(最初のVLPピークは示されていない)。目的物質は緑色で示す。
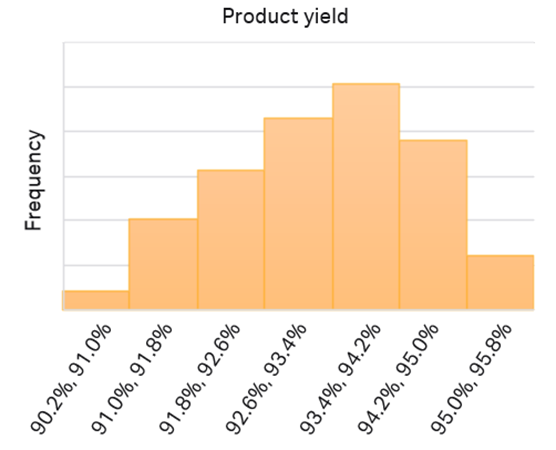
図9. 初期モデルの予測性を1000ポイントLHSサンプリングで評価した。平均収率は93.3%、95%信頼区間は±0.1%と予測
結論
限られた実験とメカニスティックモデリングを組み合わせることで、VLPの精製プロセスの効率的な最適化および設計空間の特性解析が可能となりました。この新たなアプローチは、現時点ではダウンストリームのプラットフォームプロセスが存在しない場合に、いつでも使用できる可能性があります。最終的に完成したモデルから製品品質特性や、この特性とプロセスパラメーターとの関連について理解が深まりました。このアプローチは、欧州医薬品庁(EMA)および食品医薬品局(FDA)が規定するクオリティ・バイ・デザインに関するガイドラインで求められています。メカニスティックモデルはスケールアッププロセスの結果を予測することができ、使用できるサンプル量が限られている新規医薬品の初期のプロセス開発においてきわめて重要です。
この事例は、CEVEC Pharmaceuticals GmbHとの密接な協力の下で実施しました。 ここに示した実験データは、CEVEC Pharmaceuticalsのご厚意により使用します。