この記事は、自動翻訳ソフトウェアによって翻訳されています。自動翻訳によって生成された記事(Cytivaにより見直された記事を含む)には、単語、構文、文法などの間違いが含まれている場合があります。弊社は、コンテンツの不正確な翻訳またはその使用により生じる間違いや誤解、または損傷に対して責任を負いかねます。あらかじめご了承ください。
サイズ排除クロマトグラフィー(SEC)は、ウイルスや細胞外小胞(EVまたはエクソソーム)のような大きくて繊細な粒子のダウンストリーム工程でよく使用されます。しかし、このSECステップは生産性のボトルネックとみなされることが多く、低流速や限られたサンプル量では、ウイルスやエクソソームの精製が遅くなることがあります。Capto™ コアビーズは、このボトルネックに対処し、大きな粒子のダウンストリームを強化するために開発されました。コアビーズ技術には、リガンド活性化 コアと不活性シェルからなるクロマトグラフィー樹脂が含まれています (図1)。 この構造により、シェル内を拡散する小さな不純物を捕捉し、より大きな標的物質をフロースルーに捕捉するという二重機能を実現しています(1)。Capto™ Core樹脂は、サイズ分離と結合クロマトグラフィーを組み合わせることで、エクソソームやその他の大きな物質の精製においてSEC樹脂に代わる優れた代替品となり得ます。
図1.Capto™コアビーズ技術には、リガンド活性化 コアと不活性シェルからなるクロマトグラフィー樹脂が含まれています。
コアビーズの機能性
不活性なシェルとリガンド活性化された コアの組み合わせにより、分子の群分離と同時に高いサンプル負荷が可能になります。 各ビーズのコアは疎水性と正電荷を持つリガンドで機能化されており、シェルからコアに拡散するほど小さな様々な不純物を高効率でマルチモーダル結合させることができます。このマルチモーダルなリガンドにより、広いpHと塩濃度範囲でほとんどの不純物と強く結合し、ビーズからの不純物の拡散が制限されます1 。
これがコアビーズ技術の優れた点で、比較的小さなクロマトグラフィーカラムで大量の試料を処理することが可能です。つまり、コアビーズを使用することで、ウイルスカプシド、エンベロープウイルス、エクソソームなどの大型で高感度な標的物質から小さな不純物を除去することができます。
コアビーズのシェルは、モノサイズの孔を持ちません。その代わり、孔径分布があり、Capto™ Core 700 レジンでは 700 kDa の球状体、Capto™ Core 400 レジンでは 400 kDa の球状体に相当する平均カットオフを有します。これらのカットオフ値は、滞留時間 3 分、ベッド高さ 20 cm のカラムで 400 cm/h に相当します(1) 。認識されるカットオフ値は流量の影響を受けます。流速が低いと、大きな物質がシェルを通過してコアにあるリガンドと結合する可能性が高くなります。したがって、流速を下げると、ウイルスやベシクルのような大きなサイズの標的物質の回収率は下がるが、不純物の除去率は向上します(図2A)。一方、流速を上げると、不純物除去率は低下するが、大きなサイズの標的物質の回収率が向上します。図2Bに、流速と収率の相関を示します。
図2.異なるウイルス(A)および異なる流速(B)に対するCapto™コアビーズの標的分子回収率。
エクソソーム精製用コアビーズ
エクソソームは、均質な小胞のグループではない。サイズや生物学的特性が異なる亜集団が含まれています。サイズに関しては、エクソソームは、他のEV、すなわちマイクロベシクルやアポトーシス小体と様々な程度で重複しています2,3。コアビーズ技術は、EVの異なるサブポピュレーションを穏やかに精製するのに有用です。
ノーマルフローろ過やデプスろ過などの標準的な中流ろ過技術で不要な大きなベシクルを除去し、必要に応じて低速遠心分離で補完することが可能です。この一次清澄化により、細胞の残骸や目的のEVサブポピュレーションよりも大きなベシクルを除去することができます。その後、コアビーズ技術を使って、目標のEV亜集団より小さい不純物を除去することができ、フィードを濃縮する必要がありません4-6。最適化された一次清澄化とコアビーズフロースルークロマトグラフィーステップの組み合わせは、エクソソーム精製の魅力的で穏やかな下流ワークフローであることが多く、回収率を低下させることなく小さな不純物をうまく除去するには、適切なタイプのコアビーズを選択し、コアビーズのフロースルークロマトグラフィー工程を微調整することが重要です。
また、必要に応じて、コアビーズ技術を結合/溶出工程に関連付け、アポトーシス体やマイクロベシクルなど、類似のサイズのEVをエクソソームの標的サブポピュレーションから除去することができます6。この結合/溶出ステップは、既存のクロマトグラフィーシステムに適合するように設計することができます。
図3.結合/溶出ステップのない穏やかなエクソソーム産生ワークフロー。
ケーススタディ:異なるCapto™ Coreレジンを使用した回収と純度
ノースカロライナ大学の Ryan McNamara 博士と Dirk Dittmer 教授は、Capto™ Core 400 および 700 レジンの回収率と純度との関係を評価しました。彼らは、タンジェンシャルフローろ過(TFF)およびPEG沈殿後のエクソソーム単離プロセスにおける精製工程として、Capto™ Core 700またはCapto™ Core 400レジンをプレパックした1mL HiTrap™カラムを使用しました(4)。この研究では、純度はタンパク質1マイクログラムあたりのエクソソーム粒子数として測定されました。30~150 nmのエクソソームは、両レジンのカットオフ値より大きく、Capto™ Core 400のカットオフは400 kDa、Capto™ Core 700のカットオフは700 kDaです。エクソソームはフロースルーで入ってくるが、タンパク質はCapto™ Coreビーズに結合するという仮定が成り立ちます(これは前述のように流速で調節できます)。では、どのCapto™ Coreビーズを使用すればよいのでしょうか。
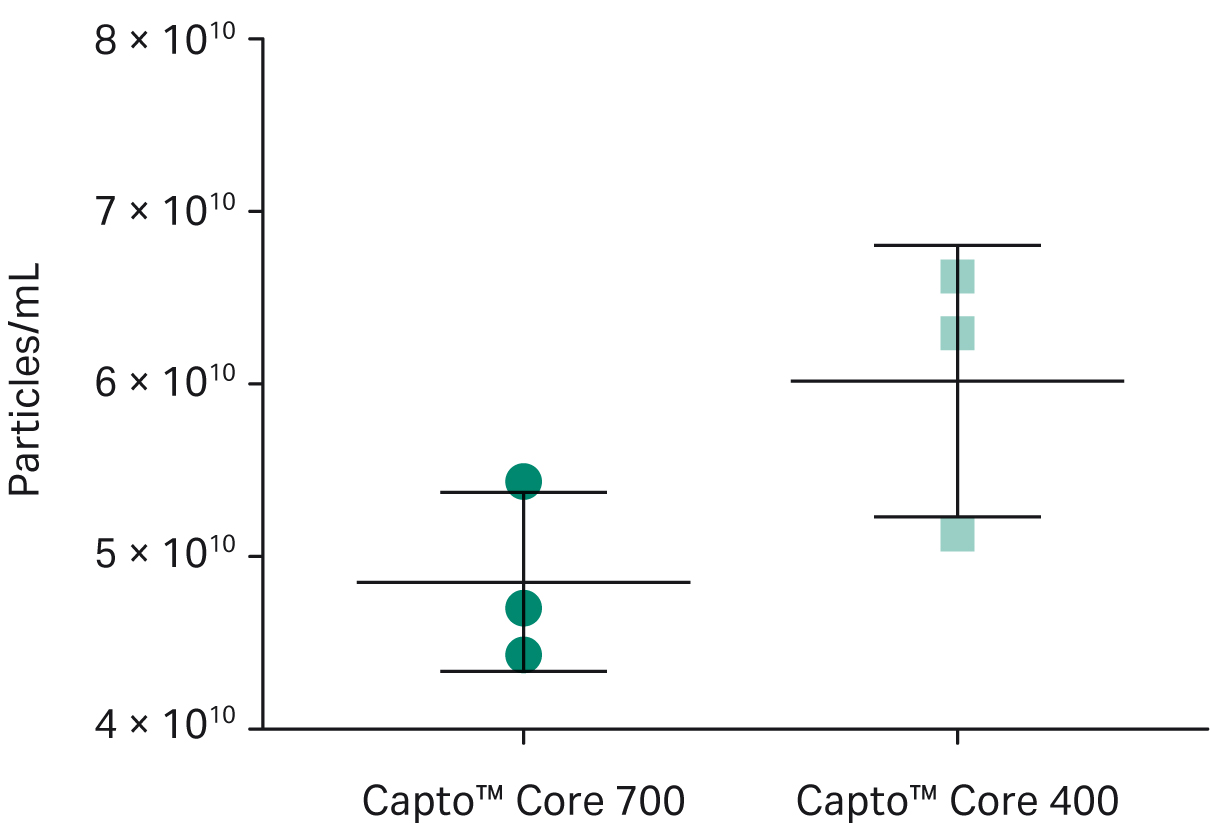
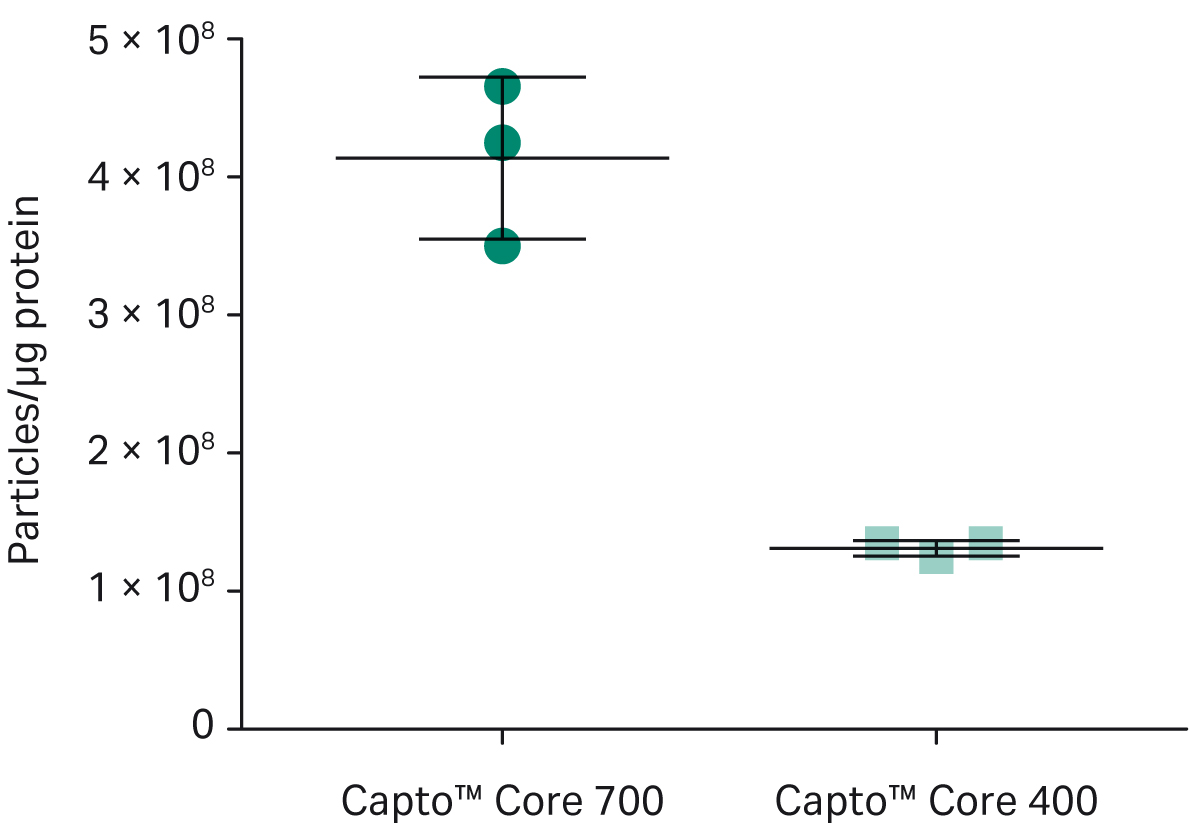
図4に示すように、エクソソーム回収率は Capto™ Core 400 で高くなりました (最終エクソソーム平均濃度は、Capto™ Core 700 レジンで 5.4 × 1010 particles/mL, Capto™ Core 400 レジンで 6.6 × 1010 particles/mL)。ただし、図5に示すように、Capto™ Core 700 レジンではより多くのタンパク質が除去されました (Capto™ Core 700 レジンでは 4 × 108 エクソソーム粒子/μgタンパク質、Capto™ Core 400 レジンでは 1.5 × 108 エクソソーム粒子/μg タンパク質)。
電子顕微鏡4,5 (図6) では、Capto™ Core 700ビーズで精製した後も、エクソソームが無傷であることが示されました。これらの結果から、純度が重要な要素である場合はCapto™ Core 700ビーズを使用することが推奨されます。Capto™ Core 700の優れた不純物除去の欠点となり得るのは、エクソソーム粒子の回収です。
図5では、Capto™ Core 700のシェルを通過するエクソソーム数の変動、すなわちエクソソーム回収が、Capto™ Core 400と比較してCapto™ Core 700の実験変動を大きくしている原因となっています。Capto™ Core 400のシェルを通過するエクソソームの数、すなわち回復のロスは、非常に限られています。
図4.Capto™ Core 700ビーズとCapto™ Core 400ビーズを用いた粒子回収率。
回収率はCapto™ Core 400ビーズが6.6 × 1010 パーティクル/mLであるのに対し、Capto™ Core 700ビーズは5.4 × 1010 と、Capto™ Core 400ビーズが高い値を示しています。流速は両レジンで同等でした。すべての測定は、ÄKTA start™クロマトグラフィーシステムで実施しました。各フロースルーの画分は、Particle Metrix ZetaView™ナノ粒子追跡アナライザーを使用して評価し、テトラスパニンタンパク質CD63、CD9、CD81の定量免疫ブロッティングで検証しました。
図5.Capto™ Core 400およびCapto™ Core 700ビーズを使用したエクソソーム精製後の生成物純度。製品純度は、Capto™ Core 700ビーズを使用した方が優れていました。4 ×108 粒子/μgタンパク質に対して、Capto™ Core 400ビーズでは1.5 ×108 エクソソーム粒子/μgタンパク質でした。タンパク質含有量はBCAアッセイで分析しました。すべての操作は、ÄKTA start™クロマトグラフィーシステムで実施しました。各フロースルーの画分は、Particle Metrix ZetaView™ナノ粒子追跡アナライザーを使用して評価し、テトラスパニンタンパク質CD63、CD9、CD81の定量イムノブロッティングで検証しました。
図6.Capto™ Core 700ビーズで精製した後のフロースルー画分からの電子顕微鏡画像。精製後のエクソソームは無傷です。
まとめ
ウイルスや細胞外小胞のような大きくて繊細な物質も、スケーラブルに精製でき、不純物除去や高い回収率が得られます。コアビーズを使用することで、フロースルーで優しく、素早く、効率的に不純物を除去することができます。フロースルーのパラメータを最適化することにより、エクソソームのような様々なサイズや不純物プロファイルを持つ大きな物質に対して、回収率と不純物除去率のトレードオフを選択することができます。
Acknowledgements
Capto™ Core 400および700レジンをエクソソームフィードで評価し、データの公開を許可していただいたノースカロライナ大学のDr Ryan McNamaraとProf Dirk Dittmerに感謝いたします。
- Cytiva. Multimodal chromatography Capto Core 400 Capto Core 700 Data File. Capto Core 400 and Capto Core 700 - Multimodal chromatography resins (cytivalifesciences.com)
- McNamara, RP, Dittmer, DP Extracellular vesicles in virus infection and pathogenesis. Curr Opin Virol. 2020; 44: 129-138.
- Willms E, Johansson HJ, Mäger I, Lee Y, Blomberg KEM, Sadik M, Alaarg A, Smith CIE, Lehtiö J, EL Andaloussi S, Wood MJA, Vader P. Cells release subpopulations of exosomes with distinct molecular and biological properties. Nat Sci Reports. 2016; 6:22519
- McNamara RP, Caro-Vegas CP, Costantini LM, Landis JT, Griffith JD, Damania BA et al. Large-scale, cross-flow based isolation of highly pure and endocytosis-competent extracellular vesicles. J Extracell Vesicles. 2018; 7(1): 1541396.
- McNamara RP, Dittmer, DP Modern techniques for the isolation of extracellular vesicles and viruses. J Neuroimmune Pharmacol. 2020; Sep 15(3): 459–472.
- Guterstam P, Whitford W.Exosome manufacturing status. Future Medicinal Chemistry. 2019: (10):1225-1236