二次元電気泳動がうまく行かない・・・
成功のキーポイントは“サンプル調製” その1 (塩の除去/サンプル添加量)
(2010年7月1日配信)
「タンパク質の電気泳動はSDS-PAGEで慣れているから二次元電気泳動も平気!」と思っていざトライしたのは良いものの、、、思うような結果が出なくてお困りの方もいらっしゃるのではないでしょうか?
今回は、二次元電気泳動を成功させる重要なポイント「泳動前のサンプル調製における注意点」を取り上げます。
よくあるお問合せ 「二次元電気泳動がうまくいかないのですが・・・どうしたら良いでしょうか?」
機器取扱い方法やトラブルシュートのご相談をお受けしている弊社のお問合せ窓口であるバイオダイレクトラインには、毎週10件ほど二次元電気泳動のお問合せをいただきます。中でも、多くを占めるのが「電気泳動がうまくいかない」という内容です。
お困りの内容を聞いていると、お客さまイメージしていらっしゃる “うまくいっている二次元電気泳動” とは、以下の2つに当てはまるケースが多いです。
うまくいっている二次元電気泳動とは・・・
- スポットパターンがクリアなこと =余分な縦筋や横筋が無いこと
- 検出したいタンパク質が泳動パターンから確認できること
このような “うまくいっている二次元電気泳動” に近づくための重要なポイントのひとつとして、サンプル調製が大きく関わっています。特に「1.スポットパターンがクリアなこと =余分な縦筋、横筋が無いこと」については、サンプル調製時のコツを知っておくことが成功への近道となります。
“クリアな二次元電気泳動スポットパターン” が得られない原因は・・・
原因1 サンプル溶液から持ち込むイオン性夾雑物(塩)が多い

お問合せいただいたお客さまの泳動パターンを確認すると、上の写真のように横筋が入っているパターンがよく見受けられます。これは、一次元目の等電点電気泳動での分離が不十分であることを示しています。一次元目にて分離が不十分になる理由としては、イオン性夾雑物(塩)が多く含まれていることが挙げられます。
塩が存在すると十分に電圧が上がりません
Immobiline™ DryStrip(pH勾配固定化ゲル)での等電点電気泳動に使用するEttan™ IPGphor™ 3では、過剰の塩(イオン性夾雑物)が含まれているサンプルを泳動すると、安全な電気泳動を実施するために電圧が上がらないように設定されています。そのため、各タンパク質が等電点へ濃縮されるのに十分な電圧まで達せず、このような泳動パターンとなる訳です。
このような理由から、目安として膨潤後のImmobiline™ DryStripに含まれる塩は10 mM以下に抑えることをご案内しておりますが、塩はできるだけサンプルから除くことが望ましいです。 では、できるだけ塩が混入しないようにするには、どうしたら良いでしょうか?
●ポイント1: TCA/アセトン沈殿で塩を除く
塩が混入する要因の多くは、細胞培養液や調製に用いたバッファー(タンパク質可溶化液、ゲル膨潤液)からの混入です。また、タンパク質濃度が薄いサンプルも相対的にこれらの溶液が混入する割合が増えるので、過剰な塩として現象が現れやすくなります。この原因を排除するには2-D Clean-Up Kitでも採用されているTCA/アセトン沈殿が有効です。沈殿時/再溶解時にタンパク質をロスするリスクを考えて避けられがちな沈殿法ですが、きれいな二次元電気泳動パターンが得られなければ解析はできません。
●ポイント2: 純度の高い試薬を使う
尿素やSDSなどについてグレードの低い試薬を用いると、イオン性夾雑物が混入する可能性が高まります。グレードの高い試薬を使うことで、これは回避できます。Cytivaからも電気泳動用に品質が保たれている「PlusOneシリーズ」をご用意しています。
●ポイント3: できるだけバッファーは用事調製する
サンプル調製に用いるバッファーは新鮮なほど、塩のような夾雑物が少ない状態です。可能な限り、バッファーは用事調製して操作を進めるのが良いです。(2-D Extraction Bufferシリーズを使うことで、用事調製の手間を減らすことができます。わずらわしい試薬の計測や条件検討の手間なく、細胞や組織からタンパク質を効率的に抽出できるバッファーおよび膨潤液を調製できるキットです。試薬調製済みのドライパウダーと希釈液を混ぜるだけで簡単に使用可能です。)
用事調製が難しい場合には、バッファーは作り置きして-20℃にて2ヶ月間保存ができます。しかし、保存期間が2ヶ月を超えたり、凍結融解を繰り返したりすると、尿素の分解などが原因で夾雑物が混入するリスクが高まるため、使用してはいけません。
●ポイント4: 成功している人の手法を参考にする
論文や周囲の研究者など、成功している人の方法を採用することもひとつの解決方法です。
自身のラボで年間に1,000枚以上の二次元電気泳動を実施している近藤 格先生(国立がんセンター)にご執筆いただいた「DIGE道場」では、連載第3回 「できるプロのタンパク質抽出法」にて、培養細胞からのタンパク質抽出、組織切片からのタンパク質抽出について詳しくご紹介いただきました。2D DIGEに限らず、すべての二次元電気泳動用サンプルに適用できる内容になっておりますので、ぜひご参考にしてみてはいかがでしょうか。
原因2 サンプル添加量が適切でない
夾雑物の他に “泳動がうまくいくためのポイント”としては、サンプル添加量に気をつけます。サンプル添加量が多すぎたり、少なすぎたりすると、きれいな泳動パターンは得られません。
●ポイント1: 可視化方法とImmobiline™ DryStripのpHレンジや長さから、適切なサンプル添加量を把握しておく
添加するサンプル量が適切であるかを判断するには、可視化方法とImmobiline™ DryStripのpHレンジや長さを考慮する必要があります。二次元電気泳動パターンの可視化にはCBB染色、銀染色、蛍光染色のいずれかで検出するのが一般的であり、それぞれの検出感度や検出限界は異なります(表1)。
表1 染色方法ごとの特徴
| 染色方法 |
検出感度 |
定量性 |
定量ダイナミックレンジ |
操作性 |
コスト |
| CBB染色 |
>100 ng |
○ |
103 |
簡単 |
安い |
| 銀染色 |
<1 ng |
△ |
102 以下 |
煩雑 |
安い |
| 蛍光染色 |
<1 ng |
◎ |
104 以上 |
簡単 |
高い、蛍光検出対応のイメージャーが必要 |
特に、銀染色の検出感度に対して過剰量のタンパク質を添加すると、パターン上に横筋、縦筋が多く見られます。これは電気泳動で移動したタンパク質の跡です。きちんとスポットとしてフォーカスした泳動ができているかもしれないのに、銀染色のダイナミックレンジが低いために跡に残っている微量のタンパク質がスポットと同じ濃さで検出されているのでそう見えてしまうわけです。これは過剰に現像したときにも当てはまります。この可視化方法とImmobiline™ DryStripのpHレンジの組合せから、適切なサンプル量がわかります(表2)。
表2 各Immobiline™ DryStripにおける染色法ごとの推奨サンプル量
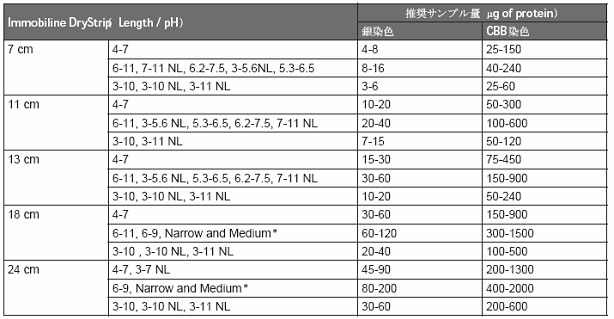
※蛍光染色時の推奨サンプル量は、銀染色でのサンプル量と同じです。
●ポイント2: 泳動前にタンパク質の定量を行う
添加するサンプル量が決まれば、あとはその量のサンプルを準備すれば良いだけです。したがって、泳動前には必ずサンプルのタンパク質の定量を行いましょう。定量は、タンパク質の沈殿/再溶解と同じくひと手間かかりますが、実験のロスを避けるための有効なサンプル調製ステップです。できるだけ正確に定量します。
※ちなみに、タンパク質定量キット2-D Quant Kitは、二次元電気泳動のサンプルバッファーに使われる界面活性剤、還元剤、尿素、キャリアアンフォライトなどの影響を受けずにタンパク質量を測定できるように最適化されています。
まとめ
サンプルへの塩の混入を防ぎ、適切な量を添加することが、“二次元電気泳動がうまくいく”ための第一歩です。
その他の泳動パターントラブル例についても、こちらの二次元電気泳動結果のトラブルシューティングにまとめてありますので、ぜひこちらもご参照ください。
 第2回 分画/溶解 編につづく
第2回 分画/溶解 編につづく
関連リンク
つづきの内容
関連テクニカル情報



