Q フィッティングがかかりません!こんな感じです。どうすればいいですか?
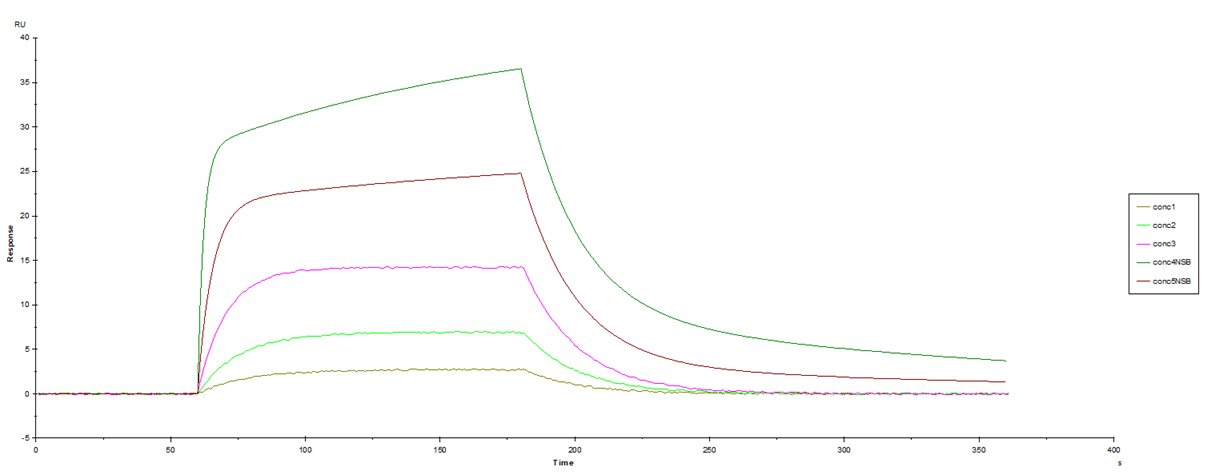
図1.センサーグラム形状
A 着眼点:センサーグラム形状を読み取りましょう。
結構きれいなセンサーグラムだな、よしよし、フィッティングしてみよう、と思われた方もいるかもしれません。でも、Biacore™のデータを見慣れてくると、これは“特異的な”相互作用をきれいに測定できていないな、ということがわかるようになってきます。
それはどこを見て?という回答をまず先にお話したいと思います。
ポイントは、解離相のカーブの形状が“二相性(あるいは多相性)”になっていないか、というところです。高濃度側2点のセンサーグラムの解離相が二相性になっていることが読み取れますか?
これは見慣れていないと判断しづらいかもしれませんが、図2のような見方をすると分かりやすいかもしれません。
このようなセンサーグラム形状は少なくとも1:1の相互作用では絶対に起こりえない形状です。このようなセンサーグラムを“見る目”は沢山のきれいな1:1相互作用のセンサーグラム形状を見る経験を積むとできるようになってきます。その経験をシミュレーションで得ることができるWebツール“Biacore™ Simul8”も是非ご利用ください。(マニュアルはこちらから)
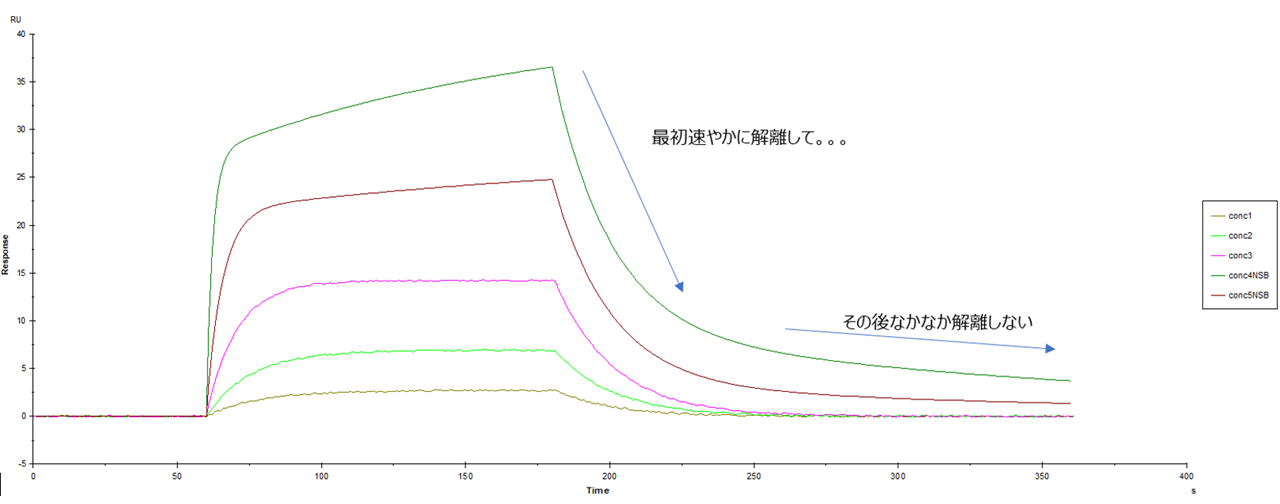
図2.二相性のセンサーグラムの読み方
1:1の相互作用を想定しているにも関わらず、このような形状が見られた場合の多くは、リガンドへの非特異的結合が起こっている、と考えられます。一般的に以下の場合リガンドへの非特異的結合が起こりやすくなります。
- アナライトの添加濃度が高い
- リガンド/アナライトの疎水的性質が高い
- 固定化したリガンドがセンサーチップ上で一部変性している場合
特に 3 はBiacoreを使い始めの方はその問題に気づかないことが多いのですが、よく原因になるケースです。(1、2に関しては、”天敵「ノンスぺ」の見つけ方・退治法”をご参照ください)
問題解決法としては、もしアミンカップリングなどの比較的リガンドにダメージを与えやすい固定化方法を採用しているなら、キャプチャー法を用いた固定化方法に切り替えたり、リガンドタンパク質の調製方法を変更したりすることになります。
では、上記のような方法で非特異的結合を取り除いたセンサーグラムでのフィッティングを見てみましょう。(図3)うーん、ほれぼれするようなきれいなフィッティングですね!
(図3.の下に追加説明も入れていますので、よろしければご参照ください)
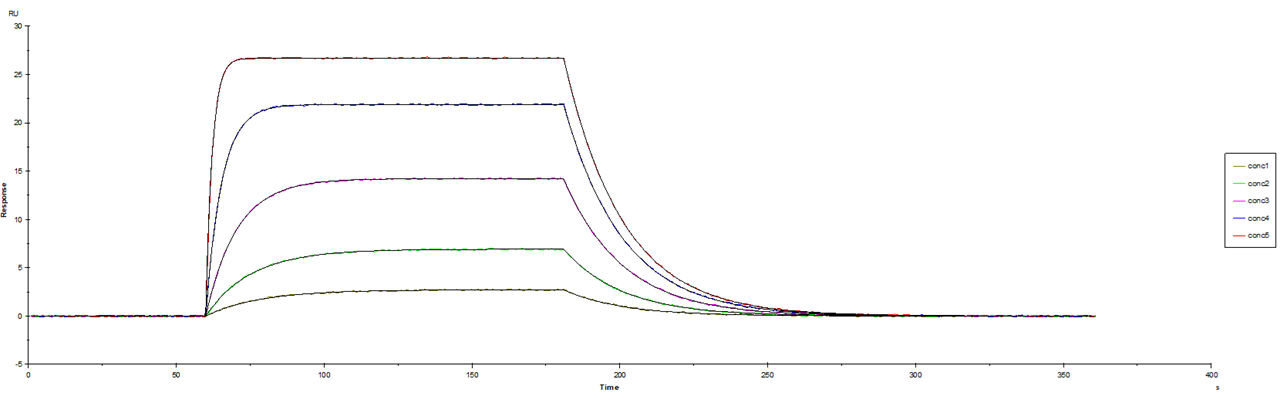
図3.非特異的結合を取り除いたセンサーグラムでのフィッティング
追加の説明
特異性という言葉はよく使われる言葉ですが、しばしばあいまいな意味で使われることがあります。
例えば、(Biacore™とは別の測定系で)”a” というタンパク質に対してA, B, C, D, E という結合候補タンパク質があって、もしAだけに結合するならば、aとAは“特異的に”結合する、というような表現です。
また“Biacore™あるある失敗例~リファレンスへの非特異結合編~”で非特異的結合という言葉が使われていますが、リファレンスセルに結合するのは非特異的結合というのであれば、リガンドに結合するだけで特異的結合と言えるのか?という勘違いも導きやすい表現です。
Biacore™の測定においては、これらの表現で用いられる“特異的”結合より厳密な意味の“特異的”結合が求められます。それは、リガンドがアナライトに対して“結合部位”特異的に結合することであり、そのような測定環境を作るということがとてもとても重要だということです。
そのために今回は結合部位非特異的な成分が混ざっていないかを見分けるための一つの手法としてセンサーグラム形状の“二相性”に着目してご説明しました。それ以外にもこの結合部位非特異的結合成分を見分ける方法はいくつかあり、特にRmaxを利用した方法は重要な方法の一つです。
これらは”Rmaxのトリセツ“にまとまっていますので、是非ご覧下さい!