イオン交換クロマトグラフィーを使いこなそう(4)
効果的な分離のための操作ポイント(1)
 第1回・第2回・第3回で、イオン交換クロマトグラフィーの基本原理についてご紹介しました。
第1回・第2回・第3回で、イオン交換クロマトグラフィーの基本原理についてご紹介しました。
第4回と第5回は、イオン交換クロマトグラフィーカラムの使い方および「効果的な分離のための操作ポイント」を詳しくご紹介します。第4回では精製操作前のポイントとして、3項目をピックアップして解説します。
- カラムの選択
- バッファーの選択と調製
- サンプルの調製と添加
1. カラムの選択
目的のタンパク質を効率的に精製するためには、最適なカラムを選択することが大切です。カラムの選択に際してのポイントをご紹介します。
陰イオン交換体と陽イオン交換体の選択
陰イオン交換体と陽イオン交換体のどちらを使うかは、タンパク質の「有効表面電荷」と「安定性」から決定します。第1回で紹介したように、タンパク質の有効表面電荷はバッファーのpHによって変化します。等電点(pI)と有効表面電荷の関係は以下のようになります。
- バッファーのpHがpIより低い:正電荷を帯びている →陽イオン交換体と結合
- バッファーのpHがpIより高い:負電荷を帯びている →陰イオン交換体と結合
安定性については、必要に応じて試験を行って確認します。各安定性を試験する際の例をまとめました。
- pH安定性の確認 : pH 2 ~ 9の範囲で1 pHごとに安定性を確認
- 塩に対する安定性 : 0 ~ 2 M NaClと0 ~ 2 M (NH4)2SO4を用いて0.5 Mごとに確認
- 有機溶媒に対する安定性 : 0 ~ 50%の範囲で10%ごとにアセトニトリルとメタノールで確認
- 温度安定性 : +4 ~+40℃の範囲で10℃ごとの温度変化に対する安定性を確認
- 高次構造および活性の安定性 : サンプルの一部を室温で一晩放置して、安定性とタンパク質分解活性の有無を確認。各サンプルを遠心して、上清の活性と吸光度(280 nm)を測定
それでは、図1のような性質をもつタンパク質で考えてみましょう。ここに示されるタンパク質ではpIがpH5.2付近であり、安定性がpH 5 ~ 8の範囲内で限られています。よって、このタンパク質の精製には陰イオン交換体を用いるべきです。
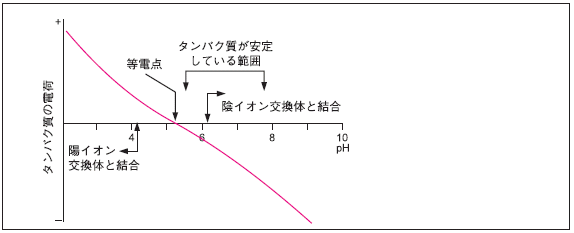
図1. 適切なイオン交換クロマトグラフィー用担体の選択
担体の選択
担体の構成成分と相違については、第3回で説明しました。担体の選択は、次のような要因に基づいて決定します。
- 精製段階(初期精製、中間精製、最終精製)
- 処理サンプル量、サンプル精製速度
- 最終精製のスケール
初期段階の精製のように高結合容量が必要な場合や、大量精製のように精製スピード(=高流速)が必要な場合には、粒子径の大きい多孔性の担体が適しています(例:Sepharose™ Fast Flow, 粒子径90μm)。それに対して、最終段階での精製など高い分離能が求められる場合には、できるだけ粒子径の小さい担体が適しています。ただし、非常に粒子径の小さい担体(例:MiniBeads, 粒子径3μm)では、圧力などの問題からスケールアップが困難です。あらかじめスケールアップや精製速度が重要だとわかっている場合では、スケールアップが可能な、ある程度粒子径の大きい担体を使って精製を検討することをおすすめします。
※詳細については、「三段階精製(第6回配信予定)」の回でご説明いたします。
2. バッファーの選択と調製
カラムは決まったけれども、どんなバッファーを使ったらよいのか、またはどのようにバッファーを調製すればよいのかわからない。そんな場合における考え方のポイントをご紹介します。
バッファーのpHとイオン強度
精製に用いるバッファーの性質については、次の3点が重要です。
- タンパク質の安定性や活性に影響を及ぼさない
- 目的タンパク質が担体にしっかりと結合できる
- 結合したタンパク質のほとんどを溶出できる
バッファーのpHが低過ぎたり高過ぎたりすると、サンプル中の目的タンパク質が活性を失ったり、沈殿を生じることがあります。特に目的タンパク質の生理活性が重要である場合は、精製条件のpHとイオン強度における安定性について、できるだけ詳細にチェックしておくとよいでしょう。
目的サンプルのpIがわかっている場合では、ある程度予測を立てて使用するバッファー条件を決定することができます。
一般にイオン強度が約0.1 Mのとき、pHをpIから約0.5 以内に近づけると、タンパク質は結合した担体から溶出し始めます。したがって、サンプルがカラムにしっかりと結合する以下のような条件のバッファーを選択します。
- 陰イオン交換体を用いる場合 : 開始バッファーのpHを目的サンプルのpIより 0.5 ~ 1以上高くする
- 陽イオン交換体を用いる場合 : 開始バッファーのpHを目的サンプルのpIより 0.5 ~ 1以上低くする
また、イオン的な性質がわからないサンプルの場合では、比較的pH条件が穏和であり、多くのタンパク質が結合することができる以下のような条件を試すのがよいでしょう。
- 陰イオン交換クロマトグラフィー
開始バッファー:pH 8.0
溶出バッファー:1 M NaClを含むpH 8.0の開始バッファー
- 陽イオン交換クロマトグラフィー
開始バッファー:pH 6.0
溶出バッファー:1 M NaClを含むpH 6.0の開始バッファー
3種の標準タンパク質の精製におけるpH至適化を行った例を図2で示します。この場合、pH5.0(左)の条件ではピークの分離が不十分ですが、pH6.5(中)、pH7.5(右)とpHを上げていくことで、分離が改善しています。
バッファーのpHが分離パターンに大きく影響することが示されたよい例です。
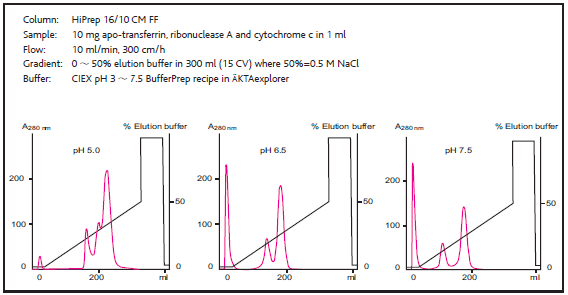
図2 標準タンパク質の分離における至適pHの選択
バッファーの選択と調製
バッファーの選択や調製についていくつかのポイントをご紹介します。
- バッファーの選択
精製を行うpHで緩衝能が働くバッファーを選択します。また、精製した成分を凍結乾燥する場合には、揮発性のバッファーを使用します。それぞれのpHにおける揮発性・非揮発性のバッファーについてまとめたPDFファイルを添付いたしますので、ご参照ください。
 揮発性および非揮発性のバッファー(29KB)
揮発性および非揮発性のバッファー(29KB)
- バッファーのイオン成分
基本的にバッファーのイオン成分は、担体のイオン交換基と同じ電荷を持つものが望ましいです。逆の電荷を持つバッファーを用いると、イオン交換の過程で局部的なpHの乱れが生じ、精製に悪影響を与える可能性があります。
注)陰イオン交換クロマトグラフィーに陽性電荷をもつリン酸バッファーが使われている文献も多く見られ、この法則は絶対ではありません。
- バッファーの濃度
バッファーの濃度は、pH緩衝能を維持できるように通常は20 ~ 50 mMが必要です。
- 調製に使う試薬とバッファーのろ過
バッファー調製には高品質の水と試薬を使用します。塩と添加剤をすべて加えて調製した後、バッファーをろ過します。ろ過で使用するフィルターについては、表1をご参照ください。
表1 ろ過で使用するフィルター
| フィルターのポアサイズ |
クロマトグラフィー担体の粒子径 |
| 1μm |
90μm以上 |
| 0.45μm |
34μm |
| 0.22μm |
3, 10, 15μm :
あるいは高純度サンプル、ろ過滅菌が必要な場合 |
- バッファーのpH に対する温度の影響
使用する温度で適切なpKa値を示すバッファーを選びます。バッファーの成分のpKaは温度によって変動します。Trisバッファーの例を表2で示します。4℃で調製したpH 7.9のTrisバッファーは、有効pH範囲(pKa±0.5)から外れているため、緩衝能は極めて低くなります。したがって、バッファーは使用予定の温度で調製しなければなりません。
表2 温度変化によるTrisバッファーのpKaへの影響
|
温度
|
pKa
|
|
0℃
|
8.85
|
|
25℃
|
8.06
|
|
28℃
|
7.72
|
3. サンプル調製と添加
サンプルを正しく扱うことは、最高の分離能が得られる近道であるとともに、カラムの劣化防止にもつながります。
サンプルの清澄化
クロマトグラフィー精製の直前にサンプルを遠心、ろ過することをおすすめします。汚染されたサンプルを使うと、分離能が悪くなるだけでなく、カラム性能の再現性が保たれなくなります。
- 遠心
脂質や細胞片などの微粒子を除去します。以下の条件を参考にして適切な分離を行ってください。
・細胞破砕液については、40,000 ~ 50,000 ×g で30分間遠心
・サンプル量が少ない場合や、タンパク質がフィルターに吸着しやすい場合には、10,000 ×g で15分間遠心
- ろ過
遠心後もサンプルが清澄化されていない場合には、ろ過を行います。あらかじめ、ろ紙や5μmフィルターでろ過した後に、上述のバッファーと同様にフィルターで処理を行います(ポアサイズについては表1を参照)。タンパク質の吸着が少ない、セルロースアセテートやPVDF製のメンブレンフィルターが適しています。
>>サンプルの処理におすすめのÄKTA™シリンジフィルター
サンプルのpHとイオン強度の調製
サンプルは脱塩操作をして、開始バッファーに交換します。脱塩操作には脱塩カラム、透析、沈殿後の再溶解などの方法があります。高塩濃度サンプルでも不純物を含まず少量であれば、開始バッファーによる希釈操作で調製が可能です。
サンプルの添加量
イオン交換クロマトグラフィーでのサンプル添加では、
サンプル添加重量が重要です。
図3で示したように、ピーク幅は成分の量に比例して広くなるので、添加量は分離能に大きく影響を与えます。十分な分離を得るためには、担体に結合するタンパク質の合計添加量が、カラムの結合容量を超えないようにしなければなりません。特にグラジエント溶出の場合には、サンプル添加量をカラムの結合容量の30%までにすることで、良好な分離能が期待できます。
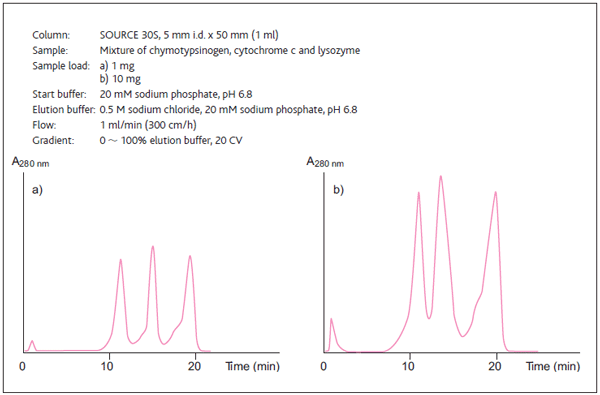
図3 サンプル添加量の増加による分離能への影響
サンプル体積は結合量に影響が無く、サンプルが希薄であっても濃縮することなく直接カラムに添加することができます。ただし、サンプル体積がカラム体積と比べて大きい場合には、サンプルバッファーがカラム環境に与える影響が大きくなります。したがって、バッファー成分の組成は開始バッファーと同じにしておく必要があります。
次回は、精製操作後のポイントをご紹介する予定です。

イオン交換クロマトグラフィーを使いこなそう
- イオン交換クロマトグラフィーの基本原理
- 分離能に関わる要因
- イオン交換担体(レジン)の違い
- 効果的な分離のための操作ポイント(1)
- 効果的な分離のための操作ポイント(2)
- ~応用編~イオン交換クロマトグラフィーを取り入れた三段階精製






