|
|||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||
|
Location:Home > テクニカル情報配信サービス > バイオダイレクトメール > バイオ実験の原理と方法 |
|||||||||||
イオン交換クロマトグラフィーを使いこなそう(5)効果的な分離のための操作ポイント(2)
1. イオン交換カラムの洗浄カラムの汚染は分離能の悪化や送液不良を招き、ひいてはカラムそのものを使用できない状態にしてしまうことがあります。サンプルの前処理も大切ですが、使用後の洗浄を適切に行ってカラムを良好な状態に保つことで、安定した精製結果を得ることができます。 高濃度の塩による洗浄イオン交換担体の最も基本的な洗浄操作であり、グラジエント溶出後のステップとして精製プロトコールに組み込まれるのが通常です。溶出ステップが終わった後に高濃度の塩(1 M NaCl)をカラムに送液し、イオン結合している残留物をカラムから除去することが目的です。送液量は5カラム体積(CV)を目安として、UV吸光度を観察しながら送液量を調節します。 一般的な夾雑物の除去非常に強固にイオン結合してしまう物質など、サンプルによっては1 M NaCl では洗浄しきれない物質がカラムに残存することもあります。そのため、定期的に以下の洗浄を行うことでカラムを安定した状態に保つことが必要です。扱うサンプルにもよりますが、目安として4~5回の精製操作に1回はこの洗浄によってカラムのメンテナンスを行うとよいでしょう。(CV = カラム体積)
強力な条件での洗浄上記の“一般的な夾雑物の洗浄”でもカラム性能が改善しない時は、より厳しい条件での洗浄を行います。汚染の原因によってそれぞれ洗浄処理が違いますので、サンプル組成などから汚染の原因を考察してみましょう。原因が特定できれば、無駄な洗浄操作を行わず効率的にカラムを良い状態に戻すことができます。 ※背圧の上昇が起きている場合では、トップフィルターに夾雑物が詰まっている要因が考えられます。沈殿しやすいサンプルや遠心/ろ過操作が不十分であったサンプルを添加した場合には、下記の洗浄よりもトップフィルターの交換を先に行うことを推奨します。洗浄よりも性能の改善に効果的であったり、フィルターに溜まっている夾雑物がカラム内部へ侵入するのを防ぐ効果があります。しかし、フィルター交換によってカラムの充填や性能に悪影響を及ぼすリスクがありますので、添付のマニュアルに沿って慎重に操作を行うことが必要です。ご不安な点や疑問などがございましたら、お気軽にバイオダイレクトラインまでお問い合わせください。
「タンパク質分解酵素を用いる方法」と「変性剤を用いる方法」があります。どちらの方法もタンパク質の高次構造を破壊することによって、析出したタンパク質を除くことが狙いです。2つの手法について、簡単な操作フローを示します。
●脂質/疎水結合タンパク質/リポタンパク質の除去 水溶液に溶けにくい物質が残存していると考えられる場合には、有機溶媒や界面活性剤を加えることで難溶性の物質を除去できます。それぞれの手法の操作例をご紹介します。
上記のような強力な条件での洗浄はカラムに負担もかかりますし、残留していると精製結果やサンプルタンパク質に影響を与えるような物質を積極的に加える操作です。なるべく不要な洗浄操作を行わないよう、サンプルの前処理や高塩濃度での洗浄といった基本的な操作は怠らないようにしましょう。 2. 精製スケールアップの際のポイントイオン交換クロマトグラフィーでの精製時間を短縮するには、大型カラムにスケールアップするよりも、小型カラムで分離操作を繰り返し、目的成分を回収したほうが簡単です。しかし、定期的に大容量のサンプルを処理する場合には、大型カラムで精製したほうが望ましい場合があります。スケールアップの一般的なガイドラインを表にまとめました。 表1 スケールアップのためのガイドライン
イオン交換クロマトグラフィーをスケールアップする際には、以下のポイントにしたがってスモールスケールとラージスケールのサイクル時間が同じになるようにします。
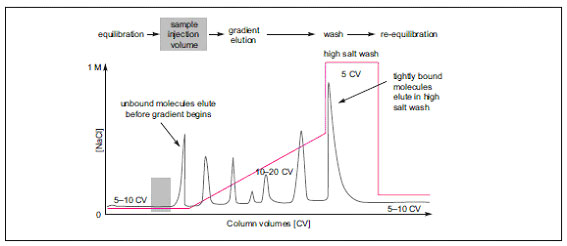
*線流速(cm/h)の求め方 線流速(cm/h) = [流速(ml/min)]×60 / [カラムの断面積(cm2)] Z = 流速、d = カラム内径(cm) スモールスケール時の分離パターンとの変化ができるだけなくなるよう、カラム担体とサンプルの接触時間を一定にするところがポイントです。接触時間を一定にするには上記のように“カラムベッド高”と“線流速”を維持させれば最も簡単です。状況によって“カラムベッド高”を変えなければならない時には、“カラムベッド高”と“線流速”の比(Rt値:下式参照)がスモールスケール時と同じになるよう、線流速を調整してください。 Rt = [カラムベッド高] / [線流速] なお、スケールアップを前提にした分離方法の条件検討を行うときには、可能なかぎりスケールアップ後に使用する担体と同じものを使うようにします。分離能を高くするために粒子径の小さな担体で条件検討することがありますが、粒子径が小さいほど背圧が上昇し、スケールアップ時に制約が生じる可能性があります。 3. 理想のクロマトグラムを得るためにイオン交換クロマトグラフィーでは、以下のような流れで精製がすすむのが理想的です。 それでは、図1のような理想的なクロマトグラムにならないときはどうすればよいのでしょうか? 具体的な例を挙げて、確認すべき事項や対応例をご紹介いたします。
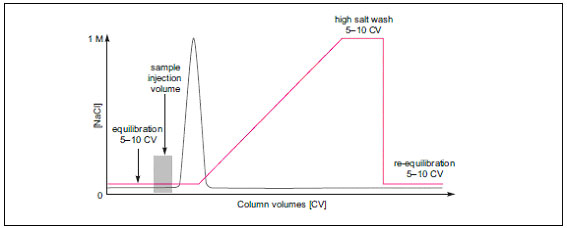
図1 理想的なイオン交換クロマトグラフィーでの分離 (グラジエント溶出) ●グラジエント溶出の前にサンプルが溶出してしまう
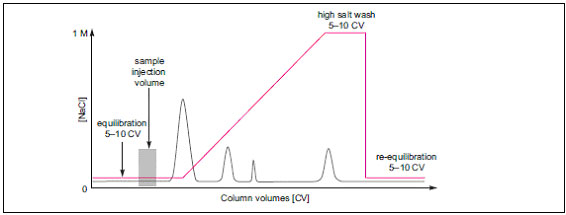
原因:バッファーの塩濃度が高すぎる、バッファーのpHが適切でない などが考えられます。 ・まずは開始バッファーについて塩濃度などの組成を再確認してください。 ●グラジエント溶出がはじまってもサンプルが溶出し続けてしまう
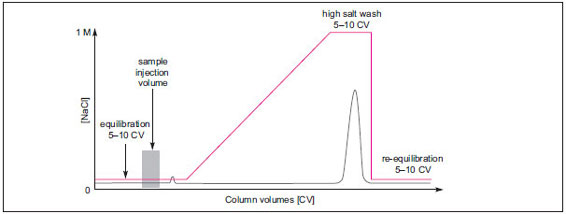
原因:サンプル添加後の洗浄が不十分です。 ・吸光度のベースラインが戻る前にグラジエント溶出を始めてしまうと、溶出初期に存在する微小ピークの検出/回収を逃す可能性があります。吸光度がベースライン値に戻った状態からグラジエント溶出が始まるように、溶出前の開始バッファーによる洗浄の送液量を増やしたプロトコールに組みなおしましょう。 ●サンプルが高塩濃度での洗浄中に溶出してしまう または目的タンパク質の溶出が非常に遅い
原因:バッファーのpHやイオン強度などが要因で、タンパク質が非常に強く結合しています。 ・グラジエントのイオン強度を高くします。溶出に非常に高い塩濃度を要する場合はバッファーのpHを変えたほうがよいでしょう。陰イオン交換体を用いている場合はバッファーのpHを低く、陽イオン交換体を用いている場合はバッファーのpHを高くします。 ●目的タンパク質の溶出が早過ぎる 原因:バッファーのpHやイオン強度などが要因で、タンパク質の結合が弱い状態です。 ・グラジエントのイオン強度を確認します。陰イオン交換体を用いている場合はバッファーのpHを高く、陽イオン交換体を用いている場合はバッファーのpHを低くすることで、結合力が上がります。 次回はイオン交換クロマトグラフィーの応用編「三段階精製」をテーマにする予定です。

イオン交換クロマトグラフィーを使いこなそう
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
|||||||||||
© 2026 Cytiva