
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > バイオダイレクトメール > バイオ実験の原理と方法 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
イオン交換クロマトグラフィーを使いこなそう (3)イオン交換担体(レジン)の違い
第3回では、イオン交換カラム内に含まれる担体(レジン)の構成成分と性質の違いについてご紹介します。 イオン交換担体(レジン)の違いイオン交換担体は、イオン交換クロマトグラフィーにおいて文字通りイオンを入れ換える場としてはたらく粒子です。その基本構造は、高分子によって形成された網目構造(マトリクス)と、そこに共有結合した荷電基(イオン交換基)から成り立っており、液相中の荷電分子を静電気的に結合したり、分離したりすることが可能です。イオン交換担体は、マトリクスに結合しているイオン交換基の種類によって電荷の正負・強弱が異なり、さらにマトリクスの表面積の広さ(多孔性)、機械的・化学的強度によって様々な特性を持ちます。マトリクスとイオン交換基について理解を深めることで、イオン交換クロマトグラフィーをより効率よく進めることができるようになります。 マトリクス(matrix)の性質イオン交換クロマトグラフィーの黎明期に用いられていた担体は、タンパク質に対する結合容量が低い・疎水性が強く生体成分を変性させる・粒径が不揃いで高流速で使用できないなどといった問題を持っていました。また、イオン強度を上昇させたり、pHを変えたりすると体積が収縮し、分離能や再現性に影響が出る場合がありました。近年では、これらの弱点を克服したポリマーやアガロースをベースとした担体が普及しています。これらの担体は物理的安定性が高く、pHの変化に耐え、過酷な洗浄条件でも使用できる溶媒耐性があり、非特異的な相互作用が起こりにくい、多孔性または非多孔性のマトリクスを基本としています。以下に、担体を構成しているマトリクスの性質を決める様々な要因をご紹介します。 材質マトリクスに用いられる素材には、主にスチレンとジビニルベンゼンを共重合させたスチレン系、アガロース糖鎖を架橋したアガロース系の2種類があります。 アガロース系のマトリクスは、基本的に天然物であり生体分子への影響が少ないのが特長です。30~200μm程度の多孔性粒子でスポンジ状の網目構造を有し、大きなベッド体積を確保できます。 スチレン系のマトリクスは均一な粒子径(単分散)での作成が容易で、精製時の圧力も安定するのが利点です。数マイクロメートルの非常に小さな粒子の作成も可能で、 技術の向上によりかつては問題となった化学的な影響の問題も克服されています。多孔性多孔性のマトリクスはイオン交換基を含む表面積が広いので、結合容量が高くなります。一方、非多孔性のマトリクスは結合容量は低くなりますが、精製時の拡散が起きにくいためピーク幅が広がらず、超高分離精製用の担体などに利用されます。ポアサイズマトリクスの微細孔(ポア)のサイズの大小によって、精製できる分子のサイズが変わります。概して、大きな分子の場合、その分子が入り込めるポアサイズを持つ担体でなければ結合効率が低くなります。逆に、小さな分子を精製する場合は、その分子に見合った小さなポアサイズを選択して大きな分子を排除します。アガロース担体の場合は、ポアサイズを厳密にコントロールすることが困難なので、ポアサイズではなくアガロースの濃度が指標となります。化学的安定性・溶媒耐性サンプル成分の非特異的な吸着を最小限に抑えるため、マトリクスは化学的に不活性であることが必要です。また、イオン交換クロマトグラフィーでは、バッファーのpHや塩濃度を変化させる必要があるため、担体には溶媒耐性が求められます。過酷な洗浄液(ex:水酸化ナトリウム)の使用が可能な担体もあります。物理的強度物理的安定性に優れた担体は塩濃度やpHが極端に変化しても担体の体積が変わらないので、カラムに再充填する必要がなく、分離の再現性が高くなります。また、物理的安定性に優れて粒子径が均一な担体は、洗浄や再平衡化の段階で流速を上げることができるため、サンプル処理量と生産性が高くなります。マトリクスの実例続いて弊社が開発した主なイオン交換担体を例に挙げ、マトリクスの実例をご紹介します。表1. イオン交換クロマトグラフィー用マトリクス
Capto™ HiReshigh-flowアガロースベースのマトリクスで平均粒子径が9 µmとなっています。タンパク質、ペプチド、ポリヌクレオチドなど荷電した生体分子を吸着します。 MonoBeads™・SOURCE™ 図1. 球状単分散粒子MonoBeads™の 電子顕微鏡像 ポリスチレンをジビニルベンゼンで架橋したほぼ完全な球状(単分散)で小さな(10 μm、15 μm、30 μm)多孔性粒子のマトリクスです(図1)。微粒子でありながらバックプレッシャーが極めて低く、高流速でもすぐれた分離能を発揮します。 MiniBeadsポリスチレンをジビニルベンゼンで架橋したほぼ完全な球状(単分散)で非常に小さな(3 μm)非多孔性粒子のマトリクスです。非多孔性のため拡散が極小で、結合容量や流速よりも高分離能を重視する微量分離や分析に適しています。 Sepharose™ 図2. 架橋アガロース(Sepharose™)の構造 Sepharose™をベースマトリクスとする担体は、イオン交換担体のほかに、アフィニティークロマトグラフィー、疎水性クロマトグラフィー用に多数ラインナップされています。 イオン交換基次に、イオン交換基について解説します。イオン交換担体の電荷はマトリクスに導入したイオン交換基で決まり、交換基が正電荷をもてば陰イオンを結合する「陰イオン交換体」、負電荷をもてば陽イオンを結合する「陽イオン交換体」となります。 一般的なイオン交換基には以下のようなものがあり、陰イオン交換体ではQやDEAE、陽イオン交換体ではSP、Sがよく知られています。 表2. イオン交換体の官能基
強イオン交換体と弱イオン交換体イオン交換体にはそれぞれ強弱があり、これはタンパク質との結合の強弱ではなく、pHの変動によってイオンとの結合状態が変化しにくいか(強い)、影響をうけやすいか(弱い)の違いを表しています。強イオン交換体とは、pHが変化してもイオン交換容量の変動がないイオン交換体という意味です(図3)。強イオン交換体はpHの変化によってプロトンを受け取ったり失ったりしないので、広いpH域で同じ荷電状態を保ちます。強イオン交換体にはQ、S、SPがあります。 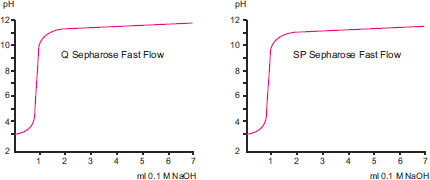 図3. 強イオン交換体Q、SP のイオン交換能を示す滴定曲線 約5 ml のQ またはSP Sepharose™ Fast Flow を1 M KCl で平衡化し、0.1 M NaOH で滴定しています。 強イオン交換体を用いると、次のような利点があります。
一方、弱イオン交換体はイオン交換基の解離度すなわち交換容量がpHによって著しく変化するものを指します。pHの変化によってプロトンを受け取ったり失ったりするので、イオン交換容量がpHによって変動します(図4)。DEAEやCM、ANXなどが知られています。 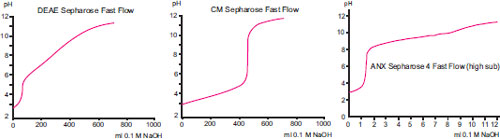 図4. pH によって変動する弱イオン交換体のイオン交換能を示す滴定曲線 これらの弱イオン交換体の利点は、強イオン交換体とは異なる選択性を発揮する点です。強イオン交換体(Q、S、SP)で必要な選択性が得られない場合は、DEAE、CM、ANXなどの弱イオン交換体を用いたSepharose™担体をお試しください。 イオン交換クロマトグラフィーでは、まず広いpH範囲で一定した交換容量を保つ強イオン交換体で条件検討を行い、分離能が思わしくなければ弱イオン交換体を用いてさらに条件を詰めていくのが一般的です。ほとんどのタンパク質の等電点は5.5 ~ 7.5 の間にあるので、強イオン交換体か弱イオン交換体のいずれかで分離することができます。 結合容量と回収率結合容量は、イオン交換担体がタンパク質などの荷電分子をどのぐらい吸着できるかを示す量的な指標で、担体1 mlあたりに結合可能な生体分子の量で表されます。(*)結合容量は、タンパク質と担体の特性および実験条件に左右されます。 初期のイオン交換担体では、大きな生体分子は担体表面のイオン交換基にしか近付けないために極めて低い結合容量を示しましたが、現在のMonoBeads™、SOURCE™などのイオン交換担体やSepharose™担体は、球状タンパク質で分子量1×106までのタンパク質に対応し、ほとんどの生体分子を分離することが可能となっています。また、最新のイオン交換クロマトグラフィー用担体は非特異的な吸着がきわめて少なく、適切な分離条件下でのサンプルの回収率は通常90 ~ 100%と非常に高くなっています。 (*)有効交換容量とも呼ばれます。また、ある操作流速下での結合容量を担体の動的結合容量といい、より実際の使用状況に近い状態での指標として用います。

イオン交換クロマトグラフィーを使いこなそうお問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva

