
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > バイオダイレクトメール > バイオ実験の原理と方法 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
イオン交換クロマトグラフィーを使いこなそう(6) ~応用編 ~イオン交換クロマトグラフィーを取り入れた三段階精製
1. 三段階精製とは三段階精製は、精製方法開発の効率化や精製時間の短縮、経済性の面から、製薬業界や研究の場で幅広く採用されている手法です。ここでご紹介する三段階精製とは、初期精製・中間精製・最終精製の3つのステップから成る精製プロセスを指します。 初期精製目的タンパク質の濃縮、安定化を目的としています。初期精製後は、目的タンパク質が濃縮され、かつその性質と活性が保持されていることが重要です。中間精製サンプル溶液中に大量に含まれている不純物の除去が目的です。不純物として、目的タンパク質以外のタンパク質や、核酸、エンドトキシン、ウイルスが挙げられます。最終精製大部分の不純物はすでにサンプルから除去されているので、残存する微量の不純物や目的タンパク質に特性がよく似た物質の除去が目的となります。それぞれの精製ステップについて、表1にまとめました。このように、各段階が担う役割は異なります。各段階の目的を考慮しながら、精製方法の選択や組合せを最適化することで効率的な精製プロセスを構築します。 表1. 三段階精製における各ステップの役割
2. 精製方法の選択と組み合わせ表2をご覧ください。タンパク質の精製はそれぞれのタンパク質がもつ性質の差異を利用して行っています。三段階精製では、異なる特性による精製方法を組み合せることで分離能を高め、最終的に純度の高い目的タンパク質を得ることがゴールです。 表2. 精製に利用されるタンパク質の特性
これらの精製方法の組み合せの際には、以下の4項目のバランスを考慮しながら三段階精製のプロセスを確立させていきます。
精製過程で処理できる目的タンパク質の量を示します。特に、初期精製において大事なファクターです。
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| クロマトグラフィー | 特長 | 初期精製 | 中間精製 | 最終精製 | 精製開始時の サンプル状態 |
精製後の サンプル状態 |
|---|---|---|---|---|---|---|
| イオン交換 | 分離能-高 処理容量-高 処理速度-高 |
★★★ | ★★★ | ★★★ | 低イオン強度、 サンプル量に制限なし |
高イオン強度、 またはpH変化、濃縮 |
| 疎水性相互作用 | 分離能-良 処理容量-良 処理速度-高 |
★★ | ★★★ | ★ | 高イオン強度、 サンプル量に制限なし |
低イオン強度、濃縮 |
| アフィニティー | 分離能-高 処理容量-高 処理速度-高 |
★★★ | ★★★ | ★★ | 特異的結合条件、 サンプル量に制限なし |
特定の溶出条件、 濃縮 |
| ゲルろ過 | 分離能-高 (Superdex™の場合) |
★ | ★★★ | サンプル量・流速に制限あり (サンプル<5%カラム体積) |
バッファー交換、希釈 | |
| 逆相 | 分離能-高 | ★ | ★★★ | サンプル量に制限なし 必要に応じて添加剤 |
有機溶媒中に溶解 (生物活性喪失のリスク) |
3. 三段階精製におけるイオン交換クロマトグラフィーの役割
表3でも示しましたように、イオン交換クロマトグラフィーは処理容量、処理速度、分離能においていずれも高いパフォーマンスを発揮します。このような性質から、三段階精製の中でもイオン交換クロマトグラフィーは重要でフレキシブルな役割を果たします。そのため、目的のタンパク質に対して適切なアフィニティー担体がない、あるいは目的タンパク質に関してほとんどデータがない場合などにもイオン交換クロマトグラフィーが活用されます。また、選択するイオン交換体(陽イオン交換体と陰イオン交換体)、精製時のpH条件、溶出方法(ステップワイズとグラジエント)といった項目を変えるだけで、全く異なる分離特性を持ちます。したがって、「陽イオン交換-陰イオン交換-ゲルろ過」、「陰イオン交換-陰イオン交換-ゲルろ過」といった複数回のイオン交換クロマトグラフィーを行う組合せによって、高純度な精製プロセスを構築できる場合もあります。
初期精製としてのイオン交換クロマトグラフィー
イオン交換クロマトグラフィーを初期精製で使用する目的は、クルードなサンプルから目的タンパク質を速やかに吸着することであり、プロテアーゼやグリコシダーゼなどの夾雑物から分離することです。pHや溶出条件を慎重に至適化して、夾雑物の吸着をできるだけ減らし、目的タンパク質の結合量が最大になるような開始条件を選びます。初期精製では処理スピードが重要であるため、溶出はステップワイズ方式で速やかに行うのがよいでしょう。
初期精製の段階では分離能はそれほど重要ではなく、それよりも処理容量や処理速度を高くすることが求められます。よって、比較的大きな粒子径(>90 μm)の担体が多く用いられます。弊社の担体では、Sepharose™ Fast Flow(粒子径90 μm)、Sepharose™ XL(粒子径90 μm)、Sepharose™ Big Beads(粒子径200 μm)がこれにあたります。ラボスケールでの精製(回収量=mg程度)では、量に応じてCapto™ HiResなどの高分離能担体を使用することもあります。これらの担体を使うことで、出発材料が比較的きれいである場合など、条件次第では一度の精製で必要な純度が得られるケースがあります。
図1に初期精製の至適化の例を示します。
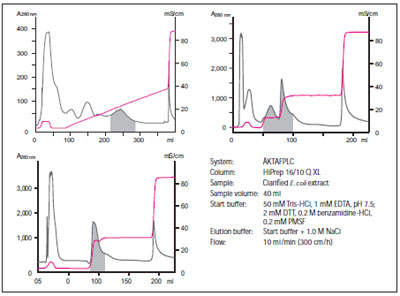
図1. イオン交換クロマトグラフィーによる初期精製と分離条件の至適化
遺伝子組換え酵素deacetooxycephalosporin C synthase (DAOCS)の初期精製の至適化を示したものです。影のついている部分が、DAOCSの溶出位置を示しています。上段2つの条件に比べ、下段の条件で得られるDAOCS溶出液量が最も少ないことがわかります。したがって、この精製系では下段のステップグラジエントカーブを採用しました。
中間精製としてのイオン交換クロマトグラフィー
イオン交換クロマトグラフィーを中間精製で使用する目的は、タンパク質や核酸、エンドトキシン、ウイルスなどの夾雑物をできるかぎり多く除去することです。通常は初期精製でサンプル容量が減っており、目的タンパク質に悪影響を与える夾雑物も除去されているので処理速度はそれほど重要ではありません。生産性(単位時間にカラム1本あたりで処理される目的タンパク質の量)を維持し、選択性(純度)をできるかぎり高めるため、処理容量と分離能を重視します。通常はグラジエント溶出、あるいは多段階のステップワイズ溶出で分離を行います。
中間精製に使用する担体は、高結合容量、高分離能が求められます。また、初期精製と異なる選択性を持つ担体を使用することも重要です。このステップでは、Sepharose™ High Performance(粒子径34 μm)、SOURCE™ 15(粒子径15 μm)、SOURCE™ 30(粒子径30 μm)が多く利用されています。
最終精製としてのイオン交換クロマトグラフィー
最終精製に用いるサンプルでは、ほとんどの夾雑物はすでに除去されています。しかし、目的タンパク質の構造変異体などの類似成分や核酸、ウイルス、エンドトキシンなど微量の夾雑物が残留している状態です。最終精製の目的は、これらの構造変異体や微量の夾雑物を用途に応じた許容水準まで減らすことです。したがって、最終精製ではできるかぎり高い分離・純度が重要視されます。
では、最終精製において最高の分離能を引き出すためにどのような点に気をつければよいのでしょうか? まず、粒子径の小さい高効率の担体の使用が必須です。ラボスケールの場合はCapto™ HiRes(粒子径9 μm)、ラージスケールではSOURCE™ 15(粒子径15 μm)、SOURCE™ 30(粒子径30 μm)と状況に応じて担体を選択します。最終的には、精製後の目的タンパク質の純度が十分になるよう、グラジエント溶出条件の至適化を行います。
図2は、リコンビナント
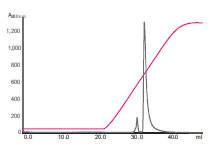
図2. 粒子系の小さな高分離能カラムを用いた最終精製
陰イオン交換クロマトグラフィーとヘパリンアフィニティークロマトグラフィーでリコンビナント
まとめ
イオン交換クロマトグラフィーは応用範囲が広い精製方法です。目的に合わせた担体の選択や分離条件の至適化によって、初期・中間・最終精製のどのステップでも力を発揮します。目的タンパク質の精製に適した担体の選択や溶出条件、他手法との組合せを検討し、効率的な精製プロセスを組むことが重要です。

イオン交換クロマトグラフィーを使いこなそう
- イオン交換クロマトグラフィーの基本原理
- 分離能に関わる要因
- イオン交換担体(レジン)の違い
- 効果的な分離のための操作ポイント(1)
- 効果的な分離のための操作ポイント(2)
- ~応用編~イオン交換クロマトグラフィーを取り入れた三段階精製
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva
 本年も引き続き、イオン交換クロマトグラフィーのTechnical Tipsをお届けします。
本年も引き続き、イオン交換クロマトグラフィーのTechnical Tipsをお届けします。 処理容量
処理容量