
|
||
|---|---|---|
|
|
||
|
Location:Home > テクニカル情報配信サービス > バイオダイレクトメール > バイオ実験の原理と方法 |
||
抗体精製をマスターしよう (6)ポリクローナルIgGの精製プロトコール
ポリクローナルIgG の精製の前に精製を始める前に、リガンドとカラムサイズの選択について、考えておきましょう。 リガンドの選択ポリクローナルIgG は、抗原を動物に免疫して作製した抗血清から精製します。IgG とProtein AまたはProtein G との親和性は、動物種により異なります。第1回でご紹介した「図6 代表的な抗体クラスの生物学的性質」を参考にリガンドを選択してください。 本記事下部の、ポリクローナルIgG のアフィニティークロマトグラフィー精製例の項で、動物種ごとの親和性について触れていますので、こちらもご参照ください。 カラムサイズの選択血清中のIgG 濃度は10 mg/ml を超えるので、血清量が多い場合は5 ml カラムを使用してください。 それでは、具体的なポリクローナルIgG精製のプロトコールを確認しましょう。 HiTrap™ 抗体精製カラムを用いた精製プロトコール準備するバッファー
Protein G はProtein A よりIgG との親和性が強いため、溶出バッファーの組成、pH が異なります。 【溶出条件】 Protein A: pH 3.0~6.0、Protein G: pH 3.0以下 サンプルの調製1 ml カラムへの添加血清量の計算おおよその血清中のIgG 濃度を 10 mg/ml として、カラムの最大結合容量から添加量を計算します。実際に添加するサンプル量は、その1/2 までにします。(最大添加量については下記リンク先をご参照ください。 HiTrap™ カラムを連結することで、処理サンプル量を増やすことができます。 カラムの劣化を防ぐために、塩析法(下記リンクを参照)でサンプルを調製します。保存中に沈殿を生じる場合もあるので、添加直前に遠心分離(12,000 × g, 10 分)または0.45 µm フィルターでろ過してください。 サンプル液量の増加は精製には影響しません。精製サンプル量が少ない場合には、結合バッファーで希釈(5~10 倍)してください。 HiTrap™ Protein G を用いた精製操作
ポリクローナルIgG のアフィニティークロマトグラフィー精製例原料となる抗血清中には、抗体のほかにAlbumin やTransferrin、リポタンパク質など様々な血清タンパク質が高濃度に存在します。イオン交換クロマトグラフィーは高い分離能と処理スピード、高吸着容量が特長で、タンパク質精製の初期段階で多用されています。しかし、血清が原料の場合には、これらの血清タンパク質もカラムに吸着するため、イオン交換クロマトグラフィーだけでは高純度の抗体を精製できません。 ここで紹介するProtein A やProtein G をリガンドとしたアフィニティークロマトグラフィーは、これらのリガンドがIgG のFc 領域と強い親和性を持つことを利用した精製法で、IgG をワンステップで高純度に精製することができます。IgG のProtein A やProtein G に対する親和性は、動物種やサブクラスによって異なります。「代表的な抗体クラスの生物学的性質」を参考にして、適切なリガンドを選択してください。 マウス ポリクローナルIgGマウスIgG はProtein A よりもProtein G の方が強く結合します。この例では0.3 ml のマウス血清からポリクローナルIgG をHiTrap™ Protein G 1 ml で精製しました。マウスIgG をProtein A カラムで精製する場合には、サンプルおよび結合バッファーの組成を変更する必要があります。(これらの組成については、後日ご紹介します) 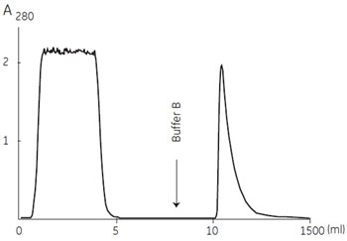
図1 マウス ポリクローナルIgG の精製 試験管には前もって数滴の中和バッファーを入れておき、すぐに溶出画分の中和を行いました。
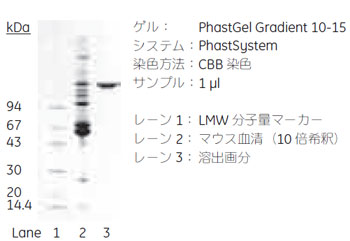
図2 溶出画分のSDS-PAGE分析(非還元) ウサギ ポリクローナルIgGウサギIgG はProtein A やProtein G のどちらにも強い親和性を示します。1.3 ml のウサギ血清をサンプルとして、HiTrap™ Protein A 5ml で精製した例を示します。 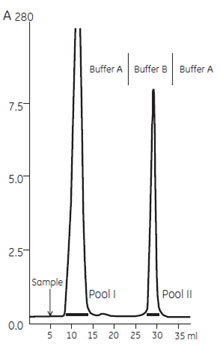
図3 ウサギ ポリクローナルIgG の精製 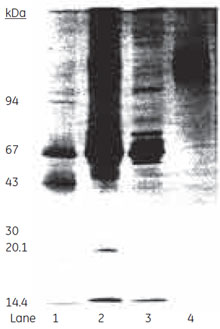
図4 各画分のSDS-PAGE分析(非還元)
【精製の流れ】 5 ml の結合バッファーを送液後、サンプルを添加しました。
ヒツジ ポリクローナルIgG の精製ヒツジIgG はProtein A への結合が弱いのでより強い親和性を示すProtein G を選択します。ヒツジ IgG とProtein G の結合の強さについての詳細は「代表的な抗体クラスの生物学的性質」をご参照ください。2.5 ml のヒツジ血清からポリクローナルIgG をHiTrap™ Protein G 5 ml で精製した例を示します。 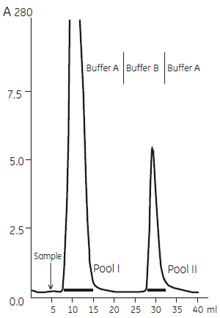
図5 ヒツジ ポリクローナルIgG の精製 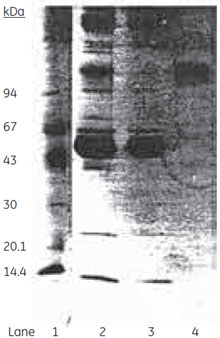
図6 各画分のSDS-PAGE分析(非還元)
【精製の流れ】 5 ml の結合バッファーを送液後、サンプルを添加しました。
マウス ポリクローナルIgG のサブクラス分離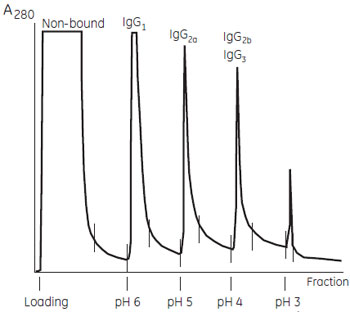 Protein A Sepharose™ CL-4B 担体を使用して、pH ステップグラジエントにより溶出し、マウス血清からサブクラスの異なるポリクローナルIgG を分離しました。マウス IgG1 とProtein A の親和性が弱い(通常pH 7.0 でも溶出がみられます)にもかかわらず、結合バッファーのpH と塩濃度を高くすることでProtein A カラムでも精製できるようになります。 (左)図7 サブクラスの分離 サンプルの溶出はpH 6.0, 5.0, 4.0 の3 種類の溶出バッファーを順番に送液して行いました。それぞれの溶出バッファーは、ピークが下がって安定するまで送液しました。
Protein A やProtein G を利用したアフィニティークロマトグラフィーにより、ワンステップでIgG を高純度に精製することができます。動物種やサブクラスを考慮したProtein A、Protein G の選択がポイントであることが、ご理解いただけたかと思います。 次回は、モノクローナルIgG の精製プロトコールをご紹介します。 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2026 Cytiva
 今回からは、いよいよ実際の抗体精製プロトコールをご紹介です。今回は、研究分野で高い頻度で用いられている抗体であるポリクローナルIgGの精製がテーマです。第5回の
今回からは、いよいよ実際の抗体精製プロトコールをご紹介です。今回は、研究分野で高い頻度で用いられている抗体であるポリクローナルIgGの精製がテーマです。第5回の