|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > バイオダイレクトメール > バイオ実験の原理と方法 |
|||||||||||||||||||||||||||||||||||||||||||||||||||
抗体精製をマスターしよう (5)抗体精製に用いるカラム・ゲル担体
抗体精製に使用されるカラムおよびゲル担体抗体精製の最初のステップでは、アフィニティークロマトグラフィーを行って抗体を回収するのが基本です。第1回・第2回でご紹介したように、Protein A/Gを使ったアフィニティー精製がもっとも一般的で、動物種や抗体サブクラスごとに適したさまざまな担体があります。 ■HiTrap™ Protein A HPIgGのFc領域に特異的に結合するProtein Aをリガンドにした抗体精製の標準カラムです。Sepharose™ HP担体の採用により迅速な精製が可能です。最大結合容量は20 mgヒトIgG /mlゲルです。大量のサンプル処理にはProtein A Sepharose™ 4 Fast Flowボトルゲルがあります。 ■HiTrap™ rProtein A Fast Flowアルブミン結合領域を遺伝子工学的に除去したリコンビナントProtein A(rProtein A)をSepharose™ Fast Flowに結合した担体を充填したカラムです。血清を含むハイブリドーマ細胞培養上清や抗血清からの抗体精製で威力を発揮します。最大結合容量は50 mgヒトIgG /mlゲルです。大量のサンプル処理にはrProtein A Sepharose™ Fast Flow ボトルゲルがあります。 ■HiTrap™ Protein G HPProtein Aよりも幅広い動物種やサブクラスのIgGに親和性を持つProtein G をリガンドにしたSepharose™ HP担体が充填されています。Protein Aに親和性の弱いラット、ヒツジ、ウマなどの抗体精製にも使用できます。最大結合容量は25 mgヒトIgG /mlゲルです。大量のサンプル処理にはProtein G Sepharose™ 4 FFボトルゲルがあります。 ■rProtein A Sepharose™ Fast Flow
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
| カップリング担体 | カップリング官能基 | 粒子径(μm) | スペーサーアーム | 排除限界(Da) |
|---|---|---|---|---|
| HiTrap™ NHS-activated HP | -NH2 | 24~ 44 | 10 原子 | N.D. |
| NHS-activated Sepharose™ 4 Fast Flow | -NH2 | 45 ~ 165 | 10 原子 | 20 × 106 |
| CNBr-activated Sepharose™ 4B | -NH2 | 45 ~ 165 | なし | 20 × 106 |
| CNBr-activated Sepharose™ 4 Fast Flow | -NH2 | 45 ~ 165 | なし | 20 × 106 |
| ECH Sepharose™ 4B | -NH2 | 45 ~ 165 | 10 原子 | 20 × 106 |
| Epoxy-activated Sepharose™ 6B | -NH2 / -SH / -OH | 45 ~ 165 | 12 原子 | 6 × 106 |
| EAH Sepharose™ 4B | -COOH | 45 ~ 165 | 11 原子 | 20 × 106 |
| Thiopropyl Sepharose™ 6B | -SH | 45 ~ 165 | 4 原子 | 6 × 106 |
| Activated Thiol Sepharose™ 4B | -SH | 45 ~ 165 | 10 原子 | 20 × 106 |
乾燥ゲル1 g は膨潤すると4~5 ml になります。必要量のゲルを秤量し、超純水(乾燥ゲル1 gあたり10~15 ml 程度)を加えると、ゲルはすぐに膨潤します。その後、ガラスフィルター上で乾燥ゲル1 g あたり200 ml の結合バッファーで15分間洗浄後、結合バッファーで75 %ゲルスラリー(ゲル懸濁液)を調製します。
結合容量とサンプル添加流速
ゲル担体の結合容量には、最大結合容量と動的結合容量の2種類があります(図1)。
前者はそのゲル担体が目的分子を回収できる上限の量をあらわし、後者は精製するサンプルが流れている状態で、どのくらい効率よく回収できるかをあらわす数値です。 動的結合容量が高い担体は高流速でたくさんの目的分子を回収できるため、短時間で効率よく目的の分子を精製できる優れた担体ということができます。
動的結合容量はサンプル添加時の流速の影響を受けて変化します。
弊社カタログに記載された数値は、添加したサンプルの漏出から計算される動的結合容量を示しています。アフィニティークロマトグラフィーの場合は、特に流速の影響を大きく受けます。図2のrProtein A Sepharose™ Fast Flow の例のように、低流速の方が動的結合量は大きくなります。 なお、スケールアップした場合には、小スケールでの実験と線流速が同じになるような設定でサンプルを添加してください。
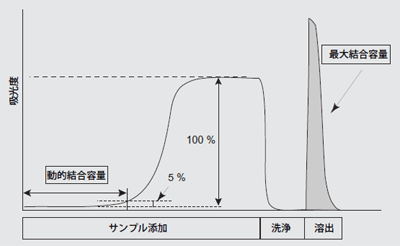
最大結合容量(maximum binding capacity)
標準タンパク質溶液をカラムに添加し、溶出液の吸光度をモニターします。溶出液の吸光度が添加サンプルと同じになるまで送液を続け、「溶出したタンパク質量」から結合量を求めます。添加流速の影響は受けません。
動的結合容量(dynamic binding capacity)
濃度既知の標準タンパク質溶液をカラムに添加し、溶出液の吸光度をモニターします。添加したサンプルの吸光度の「5 % の漏出が見られた時点の添加タンパク質量」から求めます。
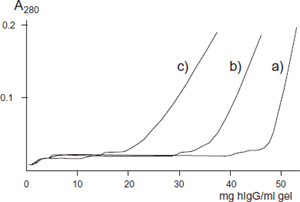
3種類の流速においてのヒトIgGの結合容量を測定しました。
カラム: rProtein A Sepharose™ Fast Flow(1.6 × 20 cm, 20 ml)
結合バッファー: 20 mM リン酸ナトリウム, pH 7.0
サンプル: ヒトIgG 0.5 mg/ml
流速:
a)3.3 ml/min(100 cm/h)
b)10 ml/min (300 cm/h)
c)15 ml/min (450 cm/h)
図中の数字はフラクション(2.5 ml/fr)番号
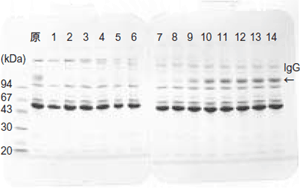
ゲル: PhastGel™ Gradient 10-15 %
サンプル: 1 μl(非還元)
染色: CBB R-250
サンプル添加流速によって値が変動するため、実際の精製と同じ条件(線流速)で測定してください。抗体濃度が高いサンプルの場合は、結合バッファーで希釈するとより正確な値が求められます。
図3はHiTrap™ Protein G 1 ml カラムを用いて、ウサギポリクローナルIgGの動的結合容量を測定した例です。5倍希釈したウサギ血清を添加(0.5 ml/min)し、カラム素通り液を2.5 ml ずつ分画しました。8つめのフラクションのレーンから抗体が漏れはじめているので、このカラムの動的結合容量はチューブ7本分(原血清3.5 mlに相当)のサンプル量とわかります。
実際の精製では、抗体濃度の変動なども考慮し、最大容量の半分を目安に精製をすすめます。
抗体の純度確認と定量方法
アフィニティー精製は、「サンプルの添加・吸着」 → 「洗浄による夾雑タンパク質の除去」 → 「溶出バッファーによる抗体の溶出」という流れで進みます。
アフィニティー精製の後は、そのまま実験に用いる場合もあれば、必要に応じてゲルろ過・イオン交換などでより高純度な精製を行う場合もありますが、いずれにしても抗体が回収できているかどうか、回収されているならどのくらいの純度で回収されているかを把握しておく必要があります。
ここでは純度確認・定量の際の注意点を簡単にご紹介します。
IgG、IgYの純度確認
IgG、IgYは、H鎖とL鎖はS-S結合により結合しています。純度確認にはSDS-PAGEを行いますが、泳動時の還元条件下ではH鎖とL鎖の2本のバンドに泳動されるため、他の抗体が混在しているかどうか識別が難しいことがあります。非還元条件下のSDS-PAGEでは1本のバンドとして泳動されるので、抗体の純度検定では還元・非還元の両方の条件下で泳動するようにしてください。
各抗体の構造、H鎖とL鎖の分子量の詳細は、抗体の物理化学的性質・生物学的性質の項をご参照ください。
IgMの純度確認
IgMは5つの免疫グロブリン基本構造がS-S結合により結合した5量体として存在している巨大分子です。そのため非還元条件下のSDS-PAGEではほとんど泳動ゲルの中に泳動されないためIgMのバンドは確認できません。しかし、不純物の確認には有効です。
還元条件下ではH鎖とL鎖の2本に泳動されます。純度検定では還元、非還元の両方の条件下で泳動してください。
H鎖とL鎖の分子量の詳細は、抗体の物理化学的性質・生物学的性質の項をご参照ください。
抗体濃度の定量
溶出液の吸光度(280 nm)と抗体分子の吸光係数から抗体濃度を計算します。溶液中に不溶物があると320 nmの吸収が高くなります。その場合には、抗体濃度が不正確になるので、遠心分離や0.45 μmフィルターろ過で不溶物を除去してから再測定してください。
今回は、抗体精製の主要ステップであるアフィニティークロマトグラフィーをテーマに、精製を行う上で必要な担体についての知識と、結合容量の考え方、純度検定・濃度確認の注意点をご紹介しました。
次回は、ポリクローナルIgGの精製プロトコールを、実例をまじえてご紹介します。
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva