パーフュージョン培養のメリット
パーフュージョン培養には多くの利点があります。 たとえば、製造中に分解しやすいバイオ医薬品だった場合は、その品質を維持するのに役立ちます。 さらに、バイオリアクターのサイズを小さくできるため、設置面積が十分確保できない施設でも取り組むことができます。バッチまたはフェドバッチ培養と比較して、パーフュージョン培養は、細胞が長期間にわたって指数増殖期に留まり、より高い生存細胞密度に到達することを可能にします。
細胞保持法
パーフュージョン培養にはいくつかの細胞保持法があります。1つは、TFF(Tangential Flow Filtration)です。培地がメンブレンフィルターを介して送り込まれる通常のフローフィルター(NFF)とは対照的に、ペリスタルティックポンプによって、細胞培養上清を透過膜表面に再循環させます。 このプロセスにより、フィルターの汚れのリスクが軽減されます。 TFFでは、分子量が膜のカットオフよりも小さい液体および化合物は膜を通過でき、一方、より大きな分子は保持されます(保持)。ATF(Alternating Tangential Flow Filtration)はTFF技術を使用しますが、ダイヤフラムポンプは膜表面の流れ方向を交互に切り替えます。
シングルユースバイオリアクター(XDR-10)を用いたTFFとATFのパーフュージョン培養の比較
以前の研究では、細胞保持法としてTFFまたはATFを使用して、波型振とうにより培養を行う細胞培養装置でパーフュージョン培養を行いました。 どちらの細胞保持法でも、同様の細胞増殖と生産性が達成されました(1、2)。
今回は、攪拌型であるシングルユースバイオリアクター(XDR-10)を用い、TFFまたはATFを使って、パーフュージョン培養の実験を行いました。攪拌型バイオリアクターにおいても、TFF、ATFともに同様の結果が得られました。
参考文献
- Clincke, M. F. et al. Very high density of CHO cells in perfusion by ATF or TFF in WAVE Bioreactor™. Part I: Effect of the cell density on the process. Biotechnol. Prog. 29, 754–767 (2013).
- Clincke, M. F. et al. Very high density of Chinese Hamster ovary cells in perfusion by alternating tangential flow or tangential flow filtration in WAVE Bioreactor™. Part II: Applications for antibody production and cryopreservation. Biotechnol. Prog. 29, 768–777 (2013).
Product line-up
連続クロマトグラフィー
バイオ医薬品製造におけるダウンストリームの工程では、不純物を取り除くためにクロマトグラフィーが使用されています。高度化するバイオ医薬品製造では、この精製をより高純度にかつ効率よく行うための技術が常に求められています。
連続クロマトグラフィーを用いた製造工程の効率化
連続クロマトグラフィー ÄKTA™ pcc
ここでは抗体精製を例に、Periodic Counter Current(PCC)chromatography、Straight-Through Processing(STP)を用いて効率化を図ったアプリケーションをご紹介します。この2つの手法を組み合せることで、担体の結合容量を最大限に引き上げられるため、カラムの サイズダウンを図ることができます。また、STPにより連続的に送液を行うことができ、時間短縮が可能となり、受けタンクなどの設備が少なく済むというメリットがあります。
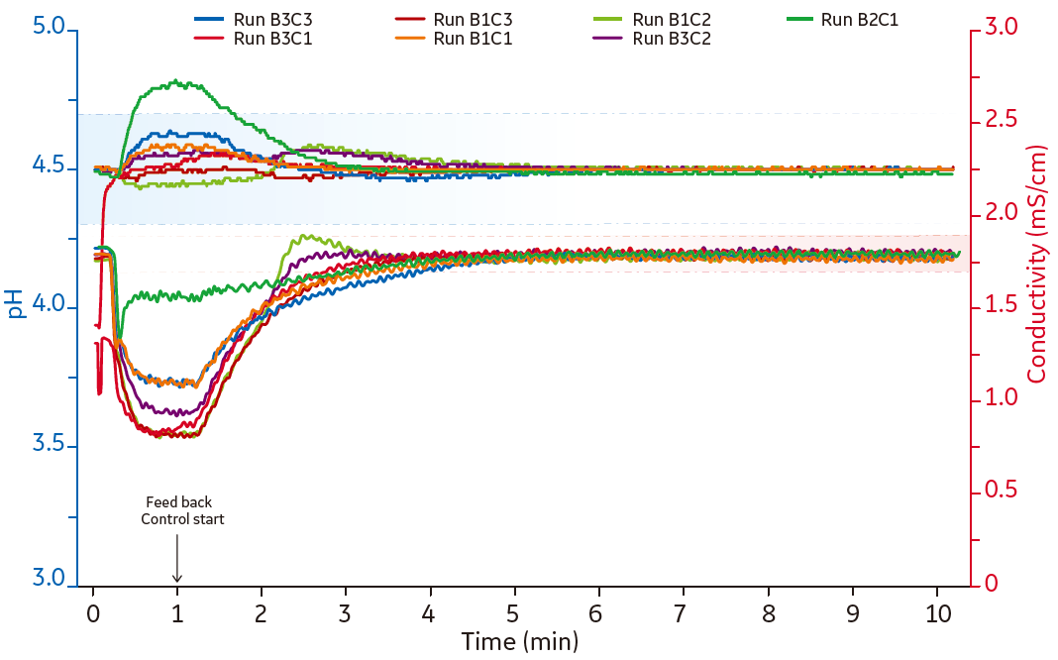
抗体のキャプチャーはProtein AをベースとしたMabSelect™ SuRe LX担体を充填した3つのカラムを使用し、ÄKTA™ pcc 75でコントロールしました(図1、2)。ÄKTA™ pcc 75は最大4つまでのカラムを同時に接続してコントロールすることが可能です。カラムの出入り口でUV測定しているため、カラムにどれだけのタンパク質が結合しているかモニターできます(図2)。
ポリッシングステップでは、ÄKTA pure™*1を使用したSTPを採用し、Capto™ S ImpActを用いたbind-elutemode(B/E)とCapto™ adhereを用いたflow-throughmode(FT)を続けて行いました(図3)。結果を図4に示します。Capto™ S ImpActから溶出されたサンプルがすぐに次のカラムに流れるため、精製時間が短縮できたことがわかります。
-
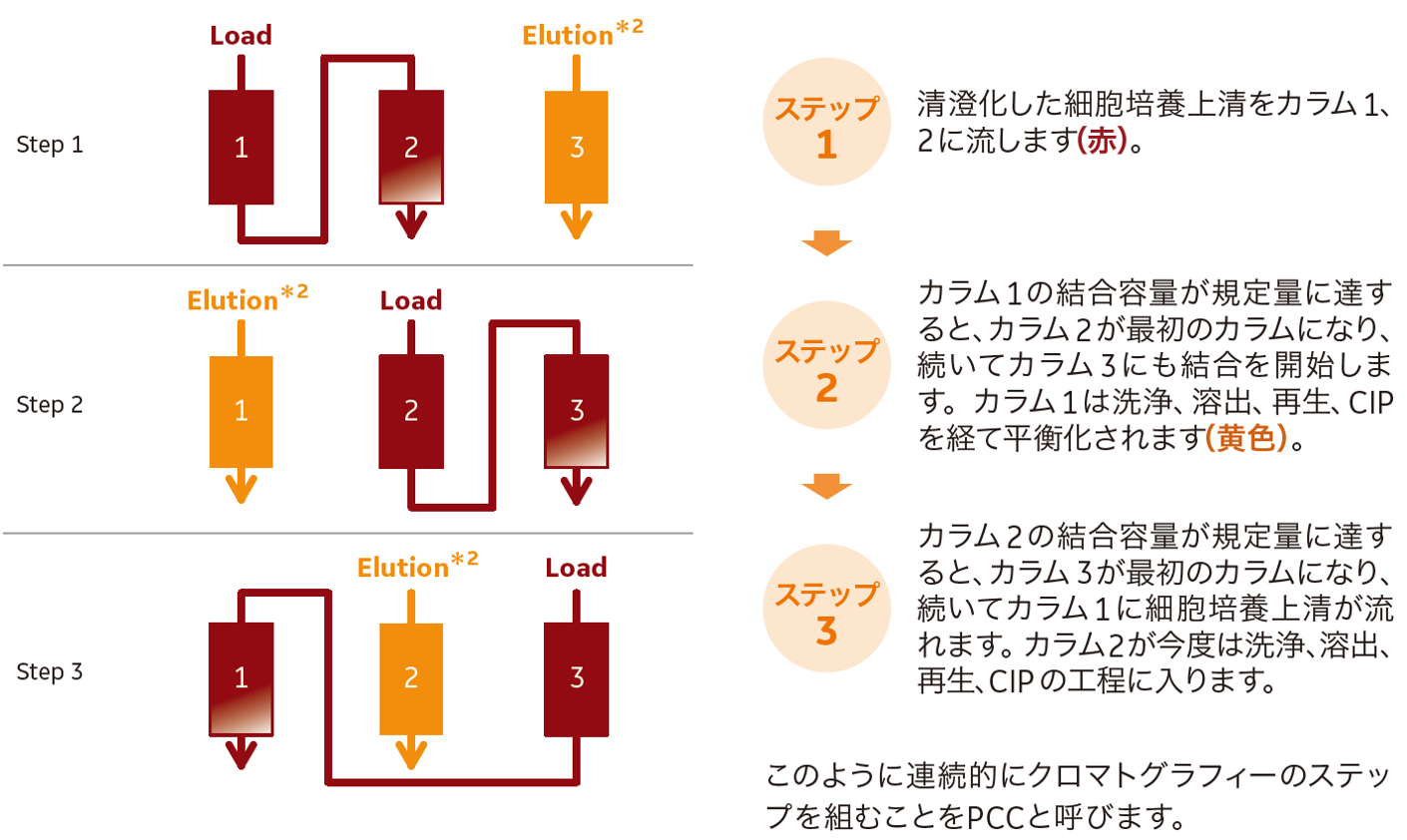
- 図1. 3カラム連続クロマトグラフィーのステップ
-
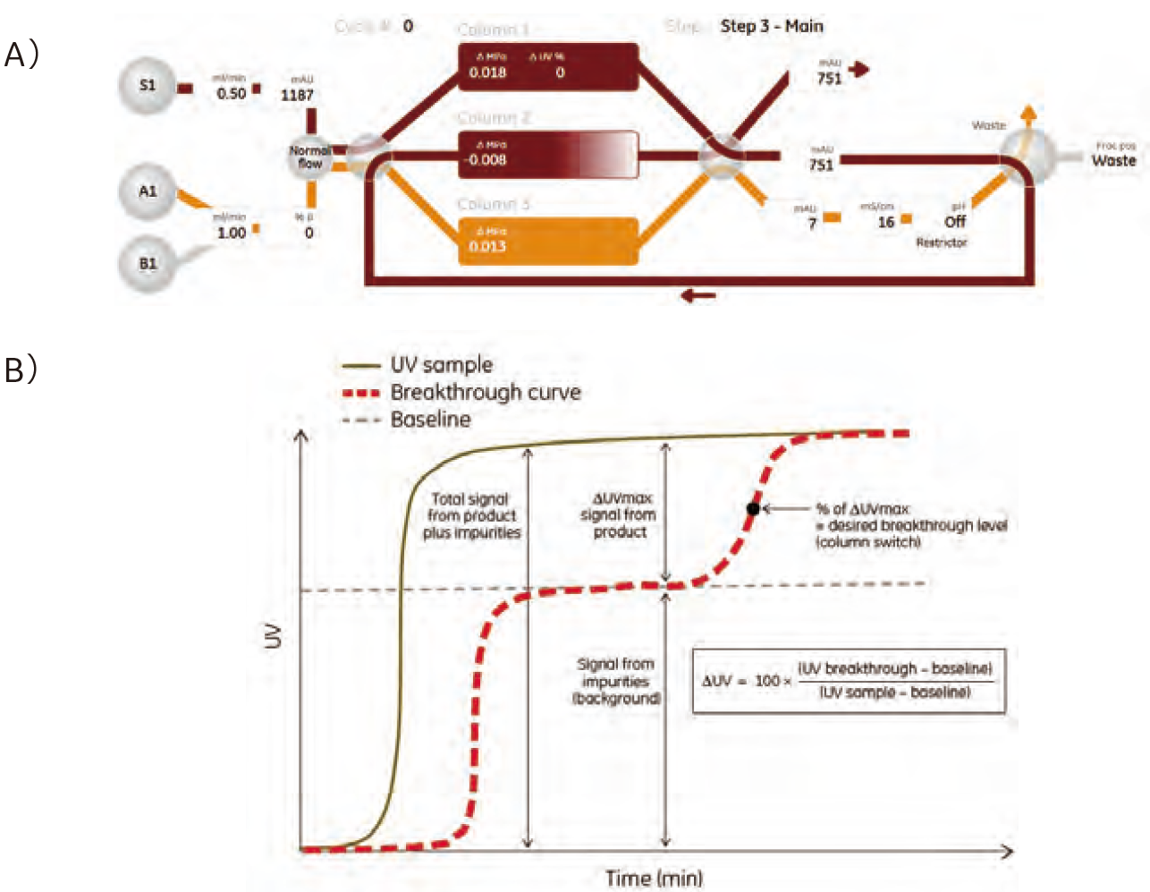
- 図2. ÄKTA™ pcc 75を使用した連続クロマトグラフィーのフロー
A)3ステップのPCC流路図
B)カラムの出入口でUV測定してタンパク質量をモニターします。時間でのコントロール法よりも正確にカラムに結合しているタンパク質の量を確認できます。
- 図2. ÄKTA™ pcc 75を使用した連続クロマトグラフィーのフロー
-
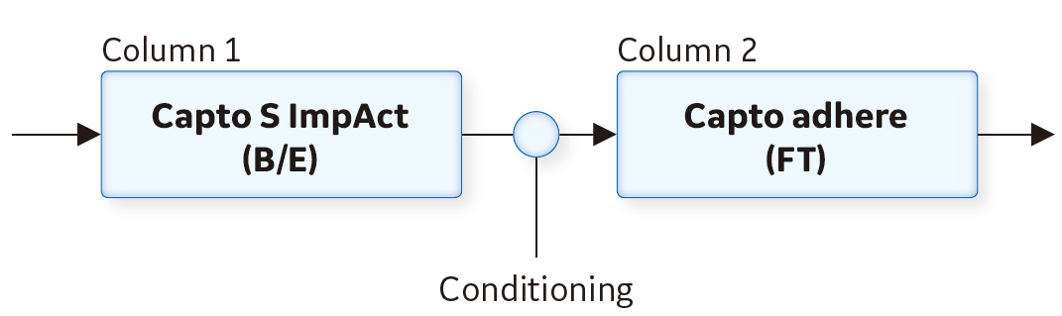
- 図3. ÄKTA pure™*1を使用したSTPにおけるポリッシングステップの流れ Column 1の溶出後、Column 2の至適条件に合わせるため、24 mM NaOHと50 mMリン酸ナトリウムでサンプル調製しています。
-
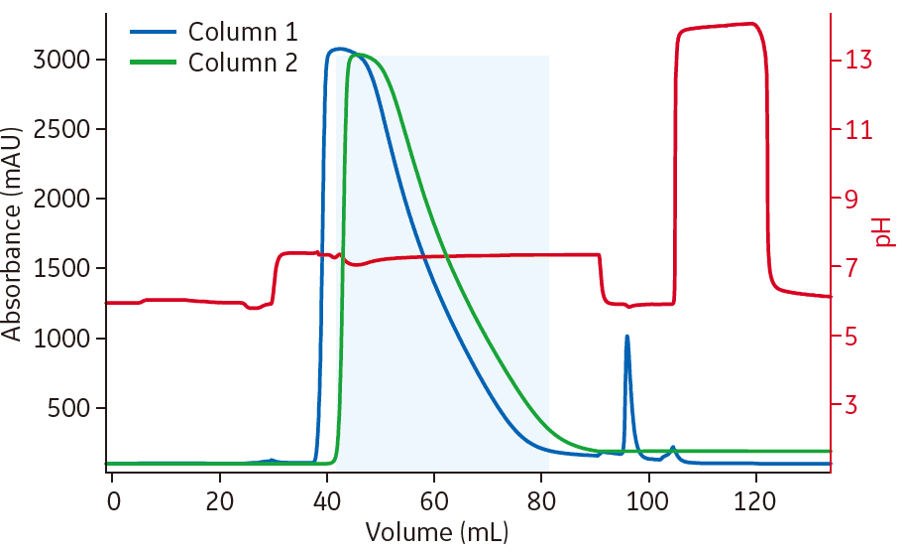
- 図4.ÄKTA pure™*1を使用したポリッシング時のクロマトグラム
Column 1のCapto™ S ImpActのクロマトグラムは青線、Column 2のCapto™adhereは緑、回収したフロースルーは水色で示しています。
- 図4.ÄKTA pure™*1を使用したポリッシング時のクロマトグラム
- *1:各種オプションを追加する必要があります。
- *2:図中のElutionの工程は、洗浄、溶出、再生、CIP、平衡化を含みます。
インライン・コンディショニング(IC)
バイオ医薬品の製造には多くのバッファーの準備、保管が必要で、特に大規模な製造ラインでは多くの労力を要します。自動バッファー調製装置(インライン・コンディショニング:IC)の活用によって、従来のバッファー調製方法と比べて、バッファータンクのボリュームや必要な床面積を小さくし、バッファー調製の効率化を図ることが可能です。
インライン・コンディショニングによるバッファータンクボリュームの削減
自動バッファー調製装置
ICにより、必要な組成のバッファーを、必要なときに、酸・塩基・塩などのストック溶液とWFI(Water for Injection)からインラインで調製することができます。
ICは単一成分のストック溶液を使うので、電気伝導度やpHを後から調製する必要がなく、複数の組成、異なる濃度・電気伝導度・pHのバッファーを柔軟にかつ仕様ごとに調製できます(図1・図3)。ICは、バッファー調製ステーションとして運用する方法(図2A)と、クロマトグラフィーやフィルトレーションシステムの一部として組み込んで運用する方法(図2B)があります。バッファー調製の間、システムはダイナミックコントロールを用い、最終的なバッファー濃度のフィードバック制御をしています。
-

- 図1. インライン・コンディショニングによるバッファー調製
-

- 図2. インライン・コンディショニングシステムの2つの運用方法
A)バッファー調製ステーションとしての運用
B)クロマトグラフィーやフィルトレーションシステムの一部として組み込んで運用
- 図2. インライン・コンディショニングシステムの2つの運用方法
製造工程におけるボトルネックを解消しましょう
重要なリソースに集中する
バッファーを調製するために必要なユーティリティは、バイオ医薬品製造施設を構築する際の主要な資本投資です。さらに、バッファーの製造はリソースを大量に消費する作業の1つであり、ワークフロー全体のボトルネックになる可能性があります。多くの施設では、バイオ医薬品の製造量増加により、必要なバッファー容量が急速に増えており、最終的にはバッファー調製用の設備が不足することになります。
培養工程と精製工程の両方のアプリケーションに適したコンテナーとパッケージで、高品質のカスタムおよび標準の調整済み溶液を提供することで、設備やリソース不足の解消に貢献します。
品質へのコミットメント
HyClone™の調製済み溶液は、製造プロセス全体を通して厳しい品質要件を満たしております。品質管理には、設計による品質、プロセス管理、およびパフォーマンステストという3ステップのアプローチを採用しています。Cytivaの設計による品質とは、サプライヤーを評価することです。設計不良モードの影響分析と、プロセス不良モードの影響分析の実行、実験計画の実施と、製造施設の設計に品質を組み込んでいます。
厳格な品質管理システムにより、私たちは一貫して、国際的に認められた規制要件のもと、プロセス全体を通じてお客様の期待にお応えします。
-
品質マネジメント
文書化と規制要件を満たすために、当社の品質管理は、グローバルな製造サイト全体でロット間同等の手順と原材料で一貫しています。 動物成分由来フリーの製造では、シングルユース液体管理システムを使用して、洗浄と洗浄検証の要件を最小限に抑え、相互汚染の懸念を軽減しています。
-
製造サイトは下記に準拠しています
●Medical device current good manufacturing practices (GMP) 21 CFR 820
●ISO 13485 for medical devices
●ISO 9001
●Eudralex Annex 1 aligned -
原材料管理
●資格のある監査済みの原材料サプライヤーからの調達を可能にするベンダー管理プログラム
●リスク軽減と緊急時対応計画のための複数の適格な原材料ソース
●米国、ヨーロッパ、および日本の薬局方の要件だけでなく、当社の品質要件も満たしている原材料
お客様のご要望に応じてパッケージや組成をカスタマイズしますので、お問合せはバイオダイレクトライン(03-5331-9336, Tech-JP@cytiva.com)までご連絡ください。
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。