この記事は、自動翻訳ソフトウェアによって翻訳されています。自動翻訳によって生成された記事(Cytivaにより見直された記事を含む)には、単語、構文、文法などの間違いが含まれている場合があります。弊社は、コンテンツの不正確な翻訳またはその使用により生じる間違いや誤解、または損傷に対して責任を負いかねます。あらかじめご了承ください。
バイオ医薬品の開発・製造に携わる人々は、宿主細胞由来タンパク質(HCP)の正確で信頼性の高い定量法を求めています。なぜ分析科学者がELISAに移行するのか、そしてELISAがどのようにプロセス開発に適合するかを詳しく見てみましょう。
宿主細胞由来タンパク質とは?
バイオ医薬品(生物学的製剤)は、微生物や動植物細胞などの生きたシステムを用いて製造されます。チャイニーズハムスター卵巣細胞(CHO)などの細胞株は、自身の生体分子を作ることに加えて、バイオ医薬品を産生する細胞工場として機能するように遺伝子操作することが可能です。
宿主細胞由来タンパク質(HCP)は、このような細胞工場で効率よく生じる生物学的な副産物です。これは回収細胞培養液(HCCF)の主な不純物の1つであり、能動的に分泌されるよりも、細胞の死滅・損傷に伴って放出される傾向があります。HCPは、製造中に除去されなければ医薬品の有効性および毒性、ならびに長期的な免疫原性に影響する可能性があります。
実際、米国および欧州を含む世界各国の薬局方には、HCPの検出およびバイオ医薬品の精製に関する規制ガイドラインが記載されています。分析化学者がどのようにして宿主細胞由来タンパク質の量を測定するか、そして酵素免疫吸着法(ELISA)がもっとも標準的な方法である理由について、詳しく見ていきましょう。
HCPとプロセス開発
新規バイオ医薬品のためのプロセス開発の一環として、各パイプラインそれぞれに特有な構成をなしているHCPを検出し、精製プロセスによってHCPが安全なレベル(通常は医薬品1 mgあたりのHCP量は数ナノグラムの範囲)まで減少することを確認します。
ご想像の通り、HCPに影響しうる要因は多数存在します。宿主細胞株はそれぞれ独自の発現タンパク質を有します。同一の細胞株であっても、アップストリームの培養条件(温度、酸性度、栄養供給など)の違いが、HCPの正確な組み合わせや存在比率に影響する可能性があります。
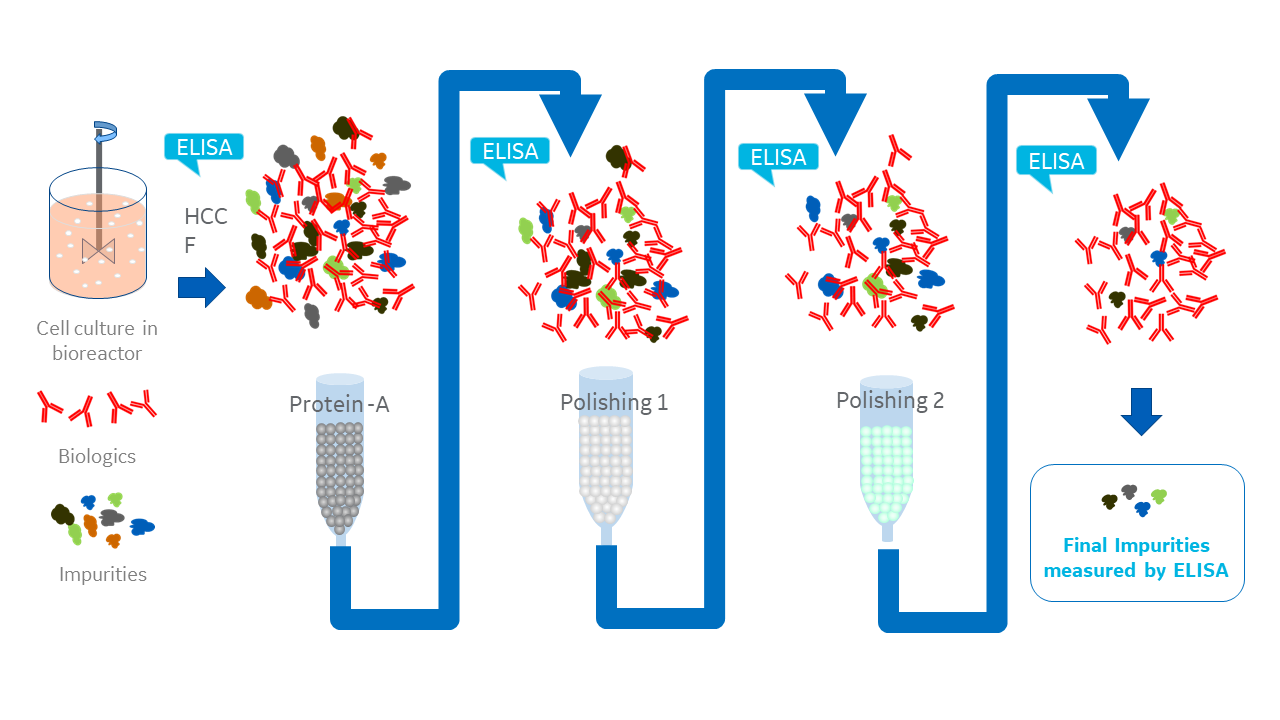
その結果、アップストリームに加えた変更が、ダウンストリームでHCPに影響することになります。そのため、プロセス開発の一環として、例えばプロテインAアフィニティークロマトグラフィーやイオン交換クロマトグラフィーの後など、ダウンストリームの精製工程のさまざまなポイントを調整・最適化する必要があると考えられます(図1)。
ここでの目的はHCPの減少であるため、調整や精製工程のそれぞれの効果を確認するためには、信頼性が高く正確なアッセイが不可欠です。それがサンドイッチELISA法です。このアッセイの感度と選択性は、複雑なHCP混合物の検出によく適しています。また、実行と自動化も容易で、高いスループットが得られます。
図1. ELISAはバイオ医薬品プロセス開発の各段階において不可欠なものである
バイオ医薬品製造時のHCP測定にELISAはどのように利用されているのか
HCP分析には、検出、定量、同定という3つの使用モードがあります(米国薬局方1132)。ELISAでは検出と定量が容易ですが、オルソゴナルな手法として質量分析法のような分析方法では、必要があれば同定を行うことができます。
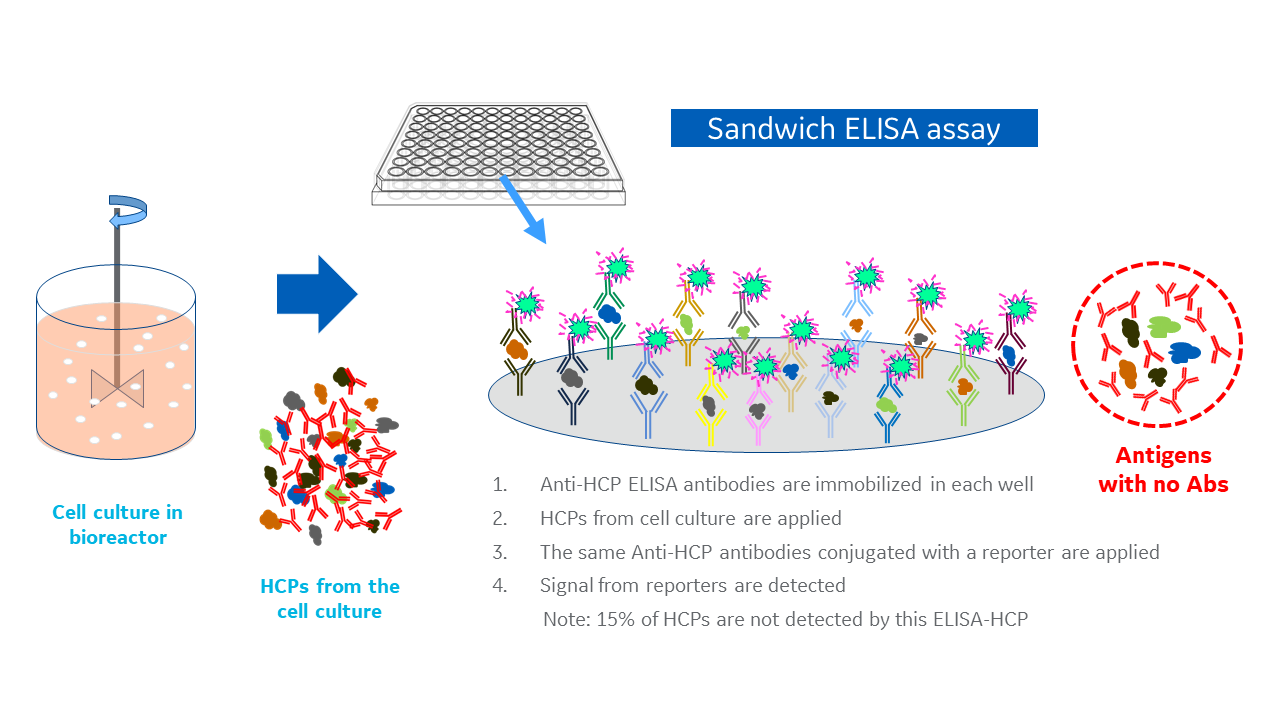
ELISAは、標的抗原(この場合はHCP集団)に対する抗体の親和性と選択性に依拠しています。HCPの有無および存在量を検出する際は、サンドイッチELISA法(図2)に従いますが、これは1回のアッセイに通常1種類の抗体を使用します。しかし、HCP集団が複雑であり、単なる1種類のタンパク質でないことを考えると、HCP抗原からなる複雑な集団に対する複数のポリクローナル抗体が1回のマルチアナライトアッセイで必要となります。
このような抗体を作製する手順は、一般的には以下のとおりです。
- モック(mock)または空の発現カセットを導入したnull細胞株を培養する。
- 適切な動物宿主(ウサギ、ヤギ、ニワトリなど)をHCPで免疫する。
- 宿主が産生した抗体を抽出し、二次元ゲル電気泳動/ウェスタンブロットで抗原のカバー率を確認する。
バイオ医薬品企業はこのようなアッセイに関して、市販の汎用(ジェネリック)キットを使用したり、プロセスやプラットフォームに適したアプローチを開発したりします(米国薬局方1132および欧州薬局方2.06.34)。これは必要性や開発段階、費用に応じて選択されます。
図2. 宿主細胞由来タンパク質に対するサンドイッチELISA法の典型例
ELISAのさまざまなアプローチ
汎用キットとは、類似した幅広い発現用宿主(CHO細胞など)に対応するように開発された市販製品です。これは簡単な方法ですが、キットのメーカーはたいていの場合、アッセイの調製法に関する詳細情報を開示しません。また、キットに使用された細胞株が、ユーザーが使用する細胞株に似ていなかったり、同じ範囲のHCPをカバーしていなかったりする可能性があります。
しかし、このようなキットは一般的な特性評価には有用であり、バイオ医薬品メーカーにとって、臨床試験の初期段階におけるプロセス開発時には優れた出発点となります。
プロセススペシフィックなアッセイはもっとも専門化されたやり方であり、特定の製品のために構築されています。これは専門のプロバイダーが開発することが多く、製品固有のアップストリームおよびダウンストリームのプロセスを考慮しています。理論的には、その製品についてELISAで可能なHCP定量法のうち、これがもっとも完全なものとなるはずですが、相当な時間と費用の投資を必要とします。
プラットフォームアッセイは、例えばある細胞株の変異体など、固有の発現プラットフォームに適合するように社内で開発することができるもので、汎用アッセイおよびプロセス固有アッセイの必要性を抑えることができます。このアプローチの強みは幅広いカバレッジと高い感度であり、同じ細胞株や類似のプロセスを用いて製造される複数の製品に適用できます。
US Pharmacopeia Chapter 1132では、ひとたび開発されたプラットフォームアッセイはその後の製品についてもバリデーションを実施できること、また、開発の全段階を通じて汎用アッセイに置き換えて製品ごとの投資額を抑えることができると示しています。
HCPQuant CHO汎用ELISAキットによるHCPの検出と測定
カバー率が今ひとつですか?
ELISAは基準となる測定法になっていますが、すべてを検出できるわけではありません。プロセス固有のアプローチであっても、得られる抗体を用いてすべてのHCPを100%カバーできるとは考えられません。
HCPの中には、動物宿主において反応を誘発するのに十分な免疫原性をもたないものや、わずかな反応しか誘発しないものがあります。抗原に対する親和性が低い抗体では、ELISAでまったく検出ができないかもしれません。
そのため、HCPの定量にELISAを用いる際に、規制当局では各アッセイのバリデーションを要求しています。このとき、多くのプロトコルでは2D gel electrophoresis/Western blotを実行し、抗HCP抗体による検出像とゲル内の全タンパク質の染色像を比較します。
このようなカバー率測定法によって、カバレッジのパーセンテージを推測することができ、また、ギャップを埋めることのできる、もっと特異的なELISAや質量分析などのオルソゴナルな分析手法を用いる方向に進むことができます。
カバー率確認の重要性が高まっていることは、2016年の米国薬局方、2017年の欧州薬局方の更新版でそれぞれ示されています(米国薬局方1132、欧州薬局方2.06.34)。同内容の日本薬局方も準備中です。
これらの更新は単なるガイドラインやベストプラクティスですが、現在ではほとんどの分析科学者が、カバー率測定が製品開発において不可欠な項目であると考えています。
宿主細胞タンパク質分析の最適化に関するご質問やサポートが必要な場合は、お近くのCytiva営業担当または、Tech-JP@cytiva.comまでお問い合わせください。