ウェスタンブロッティングの原理
ウェスタンブロッティングは、電気泳動の優れた分離能と抗原抗体反応の高い特異性を組み合せて、タンパク質混合物 から特定のタンパク質を検出する手法です(図1) 。タンパク質の存在を検出するだけでなくタンパク質の状態確認(リ ン酸化などの修飾)もできます。リン酸化を介したシグナル伝達機構の解析や狂牛病の二次検査での異常型プリオンの検出などライフサイエンスの様々な分野で、目的タンパク質の検出や解析に利用されています。
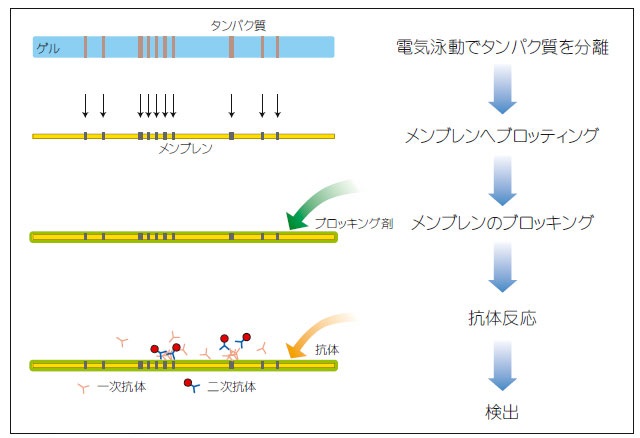
図1:ウェスタンブロッティングのフロー図
ウェスタンブロッティングの手法が発表されたのが1979年。DNAをブロッティングするのがサザン(Southern)だから、とタンパク質は「ウェスタン(Western)」と命名されました(参照:生化夜話 第11回:なぜイースタンではなくウェスタンだったのか - ウェスタンブロッティング)。検出まで含めてウェスタンブロッティング、ウェスタン法と呼ぶこともあります。
ウェスタンブロッティングの実験の流れ
まず、SDS-PAGE や等電点電気泳動、二次元電気泳動で分子量、等電点などでタンパク質を分離した後のゲル中のタンパク質 を電気的にメンブレンに移動・固定化してブロット(ブロットメンブレン)を作製します。従来 Towbin の方法、均一溶液中で電気泳動的にブロッティングする手法(タンク式)が一般的でしたが、1984 年Kyhse- Andersen のろ紙にブロッティング溶液を染み込ませて積層するセミドライ式という方法が発表されてから、操作性・経済性の面で広く受け入れられ、最近ではこちらが主流になっています。 メンブレンには、タンパク質が結合しやすい疎水性の高いニトロセルロースや、さらに疎水性に優れたPVDF (PolyVinylidene DiFluoride)が用いられます。
電気泳動で分離したタンパク質をゲルからメンブレンに移すのは、抗原抗体反応等を利用して目的のタンパク質を特異的に検出するためです。ゲルのままでは分離したタンパク質が検出反応中に拡散する、抗体がゲルの中に入るのに時間 を要するといった問題があります。また、抗体溶液容量が多量に必要となります。タンパク質をメンブレンに移すことで、 メンブレン上にタンパク質が固定され、抗体はメンブレン表面のタンパク質と反応でき、抗体溶液量も少量で済み時間 も短縮できます。またメンブレンはよほどのことがない限りゲルのように破れることもありません。
続いて、ブロットを目的タンパク質に対する抗体と反応させて検出します。抗体を検出するには、抗体を標識する必要 がありますが、目的タンパク質だけに特異的に結合する抗体は貴重・高価であることが多いので、抗体反応では主に一次抗体、標識二次抗体の二種類の抗体を用いて反応を行います。目的のタンパク質に直接結合するのが一次抗体、一次抗体を作製させた動物種由来のタンパク質に結合する抗体に標識をつけたものが標識二次抗体です(図2) 。
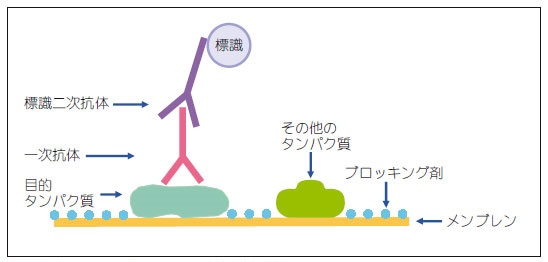
図2:ウェスタンブロッティングの検出方法
標識には酵素を用いる系、蛍光を用いる系などがあります。酵素を用いる系では、HRP(Horse- Radish Peroxidase)や AP(Alkaline Phosphatase)などで標識した二次抗体を一次抗体に反応させて、酵素活性による発色や化学発光により 検出します。化学発光による検出には、X 線フィルムへの露光検出、あるいは化学発光を検出可能なスキャナーを必要と しますが、発色法に比べて10 ~ 50 倍以上も感度が高いので、微量タンパク質の検出が容易になります(実験例)。蛍光 法は、Cy3 やCy5 で標識した二次抗体を蛍光検出するので、定量性に優れています。
ゲル電気泳動の高い分離能に、特異性が高い抗原抗体反応を応用することで、細胞抽出液などの複雑なタンパク質溶液 中に微量に含まれるタンパク質でも明瞭に検出できます(図3) 。
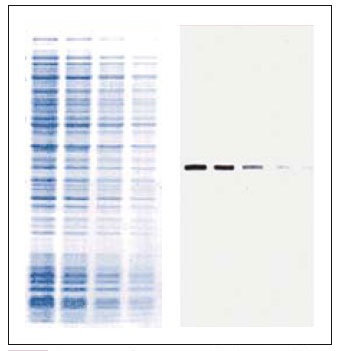
図3:ウェスタンブロッティングで得られる情報
大腸菌のシャペロンニンのサブユニットであるGroELをウェスタンブロッティングで検出しました。まず、SDS-PAGEで腸菌抽出タンパク質を分離した後にCBB染色を行いました(左)。さらに抗GroEL抗体とECL Plusを用いてGroELのバンドのみが検出されました(右)。
関連記事
電気泳動とは?
ウェスタンブロッティングのはじめのステップである電気泳動をご紹介します。大小さまざまなタンパク質が含まれるサンプルをサイズの違いに並べることで目的のタンパク質を見つけやすくなります。
ブロッティングとは?
電気泳動後のゲルからメンブレンにタンパク質を転写(ブロッティング)する方法をご紹介します。
抗体反応と検出とは?
ブロッティング後のブロッキングおよび一次・二次抗体を用いた反応についてご説明します。メンブレンから抗体を除去して別の抗体 を使って検出する方法(リプロービング・抗体除去)もご紹介します。
ウェスタンブロッティング:トラブルシューティング
実際のトラブル写真を掲載して解決策や改善のためのワンポイントをご紹介します。
ウェスタンブロッティング攻略ガイド抜粋版PDF
ウェスタンブロッティングで初めて化学発光検出の実験をされる方にも使っていただけるよう、標準プロトコールをご用意しました。
関連製品
Amersham™ ImageQuant™ 800
富士フイルムと共同開発したCCDイメージャーの最新機種。いままでよりもっと簡単にきれいな画像を撮影したい方におすすめです!
Amersham™ Typhoon™ scanner
Typhoon™ FLA 9500シリーズの後継機種で富士フイルム社と共同開発したスキャナータイプ画像解析装置
Amersham™ ECL™ シリーズ
CCDカメラ検出に適したウェスタン発光検出試薬、Amersham™ ECL™シリーズです。
Amersham™ QuickStain
Cy5とラベリングバッファーのキットで、SDS-PAGEのバンドの蛍光検出やウェスタンブロッティングのメンブレン上で抗体検出バンドとトータルプロテインの蛍光検出を同時に行うことによりノーマライズすることがが可能となります。
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。