本文中に出てくるマークの意味
:ご注意 / :プロトコールを変更できる箇所 / :詳しい情報 / :トラブルシュート
抗体反応とは
ブロッティング後のブロッキングおよび一次・二次抗体を用いた反応についてご説明します。メンブレンから抗体を除去して別の抗体を使って検出する方法(リプロービング・抗体除去)もご紹介します。
抗体反応の原理
ブロッティング後のメンブレンには標的タンパク質やその他のタンパク質が結合しています(図1) 。スキムミルクなどのブロッキング剤でマスキングして、続いて反応させる抗体がメンブレンやタンパク質に非特異に結合するのを防ぎます。この操作をブロッキングと言います。
次に目的タンパク質に対する一次抗体を、続いて一次抗体に特異的な標識二次抗体を反応させます。ブロッキング、一次抗体・二次抗体の反応工程を総称して抗体反応と呼びます。
※ウェスタンブロッティング手法についてはウェスタンブロッティング攻略ガイドも参照ください。
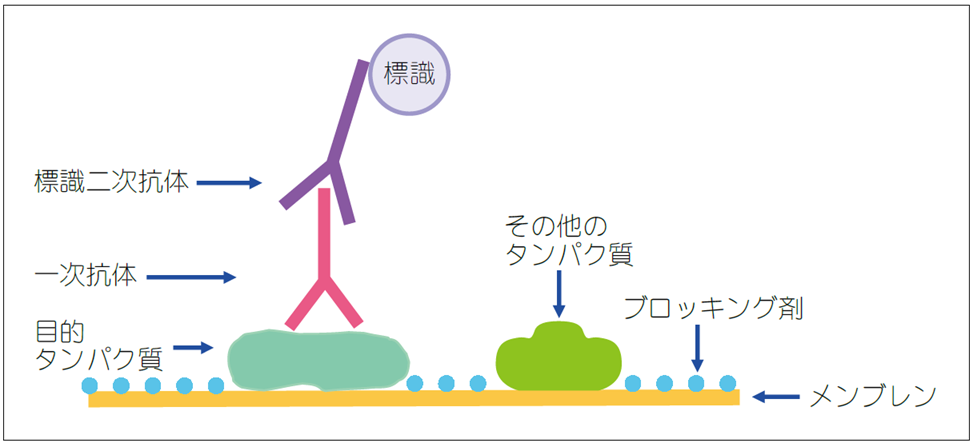
図1.ウェスタンブロッティングの検出方法
ブロッキング剤の選び方
タンパク質をメンブレンにトランスファー(ブロッティング)した後に、抗体やほかのプローブが非特異的に結合しないよう、非特異的な結合部位をあらかじめ飽和させておく必要があります。効果的なブロッキングが行われないと、バックグラウンドが高くなる原因となります(図4 )。
ブロッキング剤にはいくつか種類があります表2 。まずは5% のECL™ Blocking Agentあるいはスキムミルクで始めていただくことをおすすめします。ECL Select™あるいはECL Plex™をご使用の方は高感度キット用の2% ECL™ Advance Blocking Reagentをご使用ください。それでもバックグラウンドが高い、エキストラバンドが見られた場合は「ブロッキング条件の至適化」の項目をご参照ください。

図4.ブロッキングバッファーの違いによるバックグラウンドの比較
ラット肝臓サンプルをSDS-PAGE し、メンブレンにブロットしたものを、抗リン酸化チロシン抗体PY20 で検出しました。
ブロッキングバッファー:a)BSA in TBS-T、b)スキムミルクin TBS-T
表2.ブロッキング剤の種類
| ブロッキング試薬 | 推奨濃度 | 特徴 |
|---|---|---|
| おすすめ ECL™ Blocking Agents |
1 ~ 5% | ECL™、ECL™ Primeに至適化されたブロッキング試薬です。TBS-T、PBS-T に溶解して使用します。 |
| おすすめ ECL™ Prime Blocking Reagent |
2% | ECL Select™、ECL Plex™ に最適化されたブロッキング剤です。高感度検出システム用にバックグラウンドが低くなるように設計されています。 |
| よく使われています スキムミルク |
1 ~ 5% |
最も一般的なブロッキング試薬です。5 % スキムミルク in TBS-T/PBS-T の組合わせで多く使用します。
|
| フィッシュゼラチン | 2%程度 |
動物由来のものより水素結合を形成するアミノ基の含有量が少ないため、バックグラウンドが低くなります。通常2% 濃度で用いられます。溶解性もよく、この濃度であれば、4℃でもゲル化しません。
|
| BSA | 0.3 ~ 3 % |
価格もそれほど高価でなく、良好なシグナル強度が得られます。通常0.3~ 3% の濃度でPBS に加えて使用します。(参照文献10 ~ 18)
|
| 血清(ウマ血清あるいはウシ胎仔血清) | 10%程度 | 0.02% アジ化ナトリウムを添加した10% 血清としてよく用いられます。高価で、交差反応を引き起こす免疫グロブリンを含んでいるという欠点があります。免疫グロブリンと反応する二次抗体やProtein A を用いる系には向きません。( 参照文献12 ~ 20) |
| 界面活性剤 | 0.1%程度 |
一般的には0.1% 濃度で5% スキムミルクと組合せて使用します。
|
| 混合 | - |
(例)
|
ブロッキング剤の使い方
手順
- 推奨濃度になるようにブロッキング試薬を量り、洗浄バッファーで希釈します。
- メンブレンを”1”に浸し室温で30 分~ 1 時間振盪します。
4℃で1 晩つけておくことも可能です。 - 各検出試薬のプロトコールの一次抗体反応に従って作業を進めます。
ブロッキング条件の至適化
ECL™検出試薬のような高感度な検出系では、ブロッキング条件の至適化はバックグラウンドが低く、良好なS/N 比の結果を得るための重要なポイントです。
目的タンパク質の性質は個々によりさまざまです。また、抗体との結合性も、抗体の種類や抗原タンパク質との組み合わせにより異なります。したがって、すべてのタンパク質に対して最良の結果を出すプロトコールというものはありません。以下に、ウェスタンブロッティ ングでよく用いられるブロッキング条件至適化フローをご紹介します。
- 各検出試薬でおすすめしているブロッキング剤・条件。
バックグラウンドが高い/エキストラバンドが見られる場合は”2”以降をお試しください。 - ブロッキングの時間の延長・加温。
濃度を高くしすぎると反応にムラが生じることがあります。 - ブロッキング試薬の濃度を検討する。
濃度を上げすぎるとメンブレン上の目的タンパク質までマスキングされ、バンドが薄くなることがあります。 - 異なるブロッキング試薬を試す。
(表2)をご参照ください。
一次抗体の選び方(モノクローナル抗体とポリクローナル抗体の違い)
すべての抗体分子は1 種類のエピトープ(抗体が認識する領域)を認識します。一般に、ハイブリドーマ細胞が産生する均一な抗体をモノクローナル抗体(MAb)(図2-1)と呼びます。
一方、ポリクローナル抗体はウサギやヒツジを抗原で免疫して得られ、さまざまなエピトープを認識する抗体の混合物です(図2-2)。免疫した抗原に対する抗体を特異抗体と呼び、特異抗体の割合は抗血清中の全抗体の約10 ~ 20 % といわれています。モノクローナル抗体は抗 原特異性が高いため特定のタンパク質をターゲットにする実験や定量的な実験に使用され、ポリクローナル抗体は定性的な実験で用いられます。
抗体には、一次構造を認識するものと立体構造を認識するものがあります。立体構造を認識するモノクローナル抗体の場合、変性剤(尿素や塩酸グアニジンなど)や還元剤(DTT や2- メルカプトエタノールなど)の存在下で立体構造が変化した抗原は、認識されなくなります。
一方、ポリクローナル抗体は多数の抗体の集合なので、その中には立体構造を失った抗原を認識できる抗体も存在します。動物に免疫した抗原やクローニングに使用した抗原が変性していた場合、生成した抗体は変性タンパク質しか認識せず、天然型(高次構造をとった状態)のタンパク質には反応しないこともあります。
一次抗体が貴重な場合、実験で使用する容器を小さくすることや、メンブレンを振盪させない方法*で、液量を少なくできます。ミニゲル対応のメンブレンなら10 mL以下で行うこともできます。
*溶液がもれない程度に適当に折り曲げたパラフィルムに抗体溶液を垂らしてそこにメンブレンをのせて静置させます。ただし、少液量で反応させると、ムラが出やすいのでご注意ください。
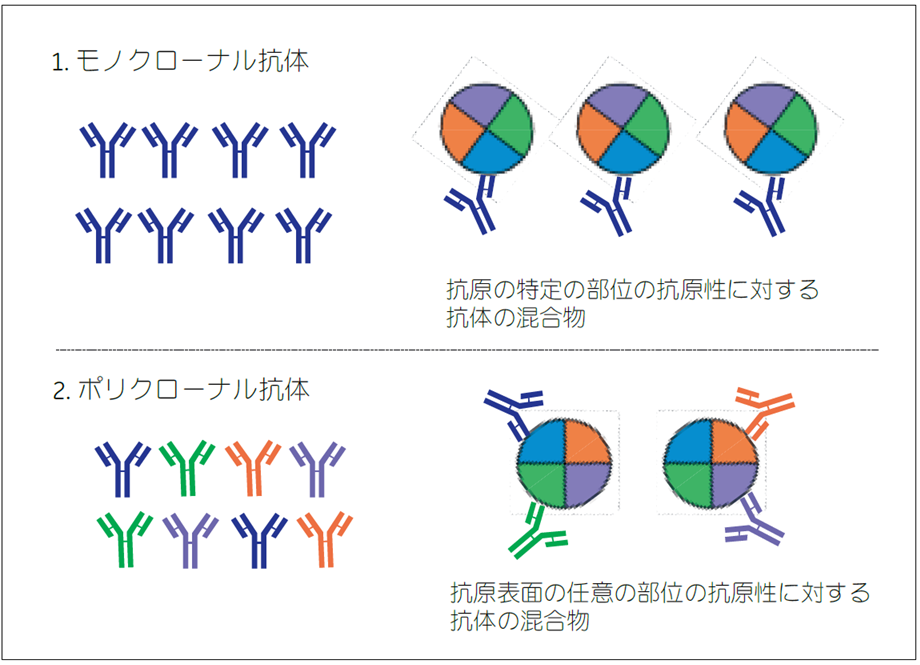
図2.モノクローナル抗体とポリクローナル抗体の特徴
HRP標識二次抗体を検出 - ECL検出試薬 -
ECL™検出試薬の検出原理
発光とは、励起状態にある基質が基底状態に戻る際に光を放出する現象またはその光を指します。化学発光は、化学反応により生じたエネルギーが光に変換されて起こるもので、ルミノールのようなcyclic diacylhydrazides の化学発光は、化学分析で幅広く利用されており(参照 文献1, 2)、またその研究も進められています。
その中でも特に、アルカリ条件下におけるHRP と過酸化水素(H2O2)によって触媒されるルミノール酸化反応について詳しく解析が進められています(参照文献3, 4)。ルミノールは酸化されると直ちに励起状態となり、基底状態へと減衰する過程で光を放ちます。
ECL™反応(参照文献2)は、フェノール環を持つ化合物などのエンハンサーの存在下で、HRP によってルミノールが酸化されたときに起こります。エンハンサーの働きで、光の放出が約1,000 倍高まり放出時間も長くなります(図3-1)。
一方、ECL™ Primeでは、基質がHRP により酸化されると、アクリジニウムエステルを生成します。このエステルは、アルカリ条件下、過酸化物と反応して化学発光を生じます。光の放出は酵素によりアクリジニウムエステルが生成される限り続きます(図3-2)。
さらに、ECL Select™は、新規の基質を用いることで、ECL™ Primeより高感度の検出を実現します。
ECL Plex™は抗体を直接蛍光標識する方法を採用しており、二次抗体をCyDye™で標識しています。抗体反応を行った後に蛍光イメージャーで検出します(図3-3)。
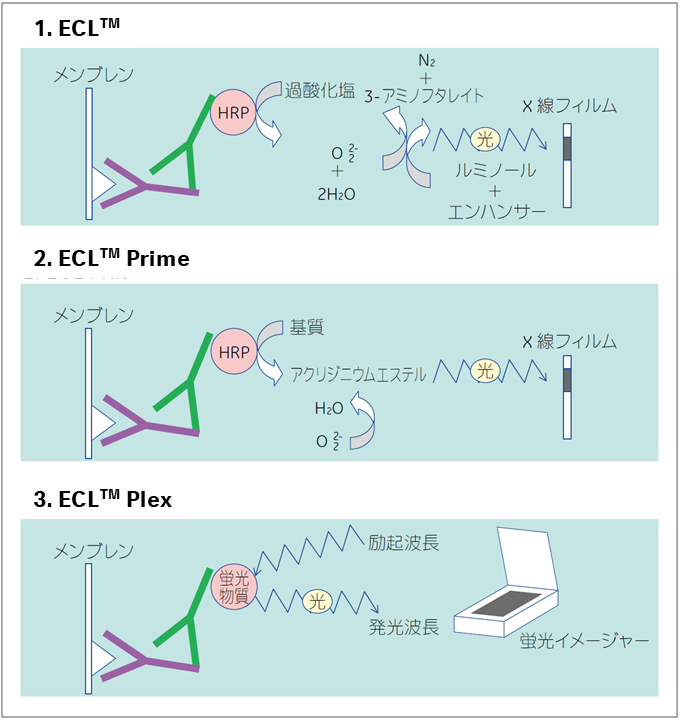
図3.検出原理
■高感度
ECL™検出試薬は、発色検出系に比べ、10 倍以上も高感度です。このため、抗リン酸化チロシン抗体を用いたウェスタンブロッティング(参照文献5 ~ 7)や、ビオチン化試薬で修飾した膜タンパク質を免疫沈降後、ECL™により検出(参照文献8、9)した例など、多く の実験例が報告されています。
■経済性
1 pg 以下のタンパク質を短時間で検出できるこのシステムでは、従来の発色法による検出系よりも一次抗体またはHRP 標識二次抗体を希釈して使用できます。したがって、貴重な抗体を有効に利用できます。
■結果の保存性
X 線フィルムや画像データ(イメージャー検出の場合)で結果が得られるので、発色に見られるようなメンブレン上での時間経過による退色がなく、保存性に優れています。スライド、写真の作成も容易になるとともに、CCD イメージャーや蛍光イメージャーによる定量化も可能です。
■安全性
DAB(diaminobenzidine tetrahydrochloride)やラジオアイソトープを使用しませんので、通常の実験室で容易に取り扱えます。
ウェスタンブロッティング検出試薬選択ガイド
| ECL Select™ (化学発光) |
ECL™ Prime (化学発光) |
ECL™ (化学発光) |
ECL™ start (化学発光) |
ECL Plex™ (蛍光) |
|
|---|---|---|---|---|---|
| 推奨アプリケーション |
最高感度の化学発光検出
|
高感度な化学発光検出
|
一般的な化学発光検出 |
一般的な化学発光検出
|
定量性に優れた高感度の蛍光多重検出
|
| 感度*1 | ECL™ Primeに対して2~8倍高感度 | ECL™ に対して40~100倍の感度 | ピコグラムオーダーのタンパク質を検出可能 | ECL™ と同等 | ECL™ に対して約20倍の感度 |
| 一次抗体希釈率の目安 | 1:5,000~1:30,000*2 | 1:1,000~1:30,000*2 | 1:500~1:5,000*2 | 1:500~1:3,000*2 | 1:100~1:5,000*3 |
| 二次抗体希釈率の目安 | 1:100,000~1:300,000*2 | 1:50,000~1:250,000*2 | 1:2,500~1:15,000*2 | 1:5,000~1:50,000*2 | 1:1,250~1:4,000*3 |
| ブロッキング剤 |
|
|
|
|
|
| リプロービング(Amersham™ Hybond™を使用) | ◎ | ◎ | ◎ | ◎ | 〇 |
| 推奨メンブレン | |||||
| 検出方法*4 |
X線フィルム(Hyperfilm™ ECL™) CCDイメージャー
|
X線フィルム(Hyperfilm™ ECL™) CCDイメージャー
|
X線フィルム(Hyperfilm™ ECL™) CCDイメージャー
|
X線フィルム(Hyperfilm™ ECL™) CCDイメージャー
|
蛍光イメージャー(Typhoon™ FLAシリーズ) CCDイメージャー |
| 検出結果の例 |

|

|

|
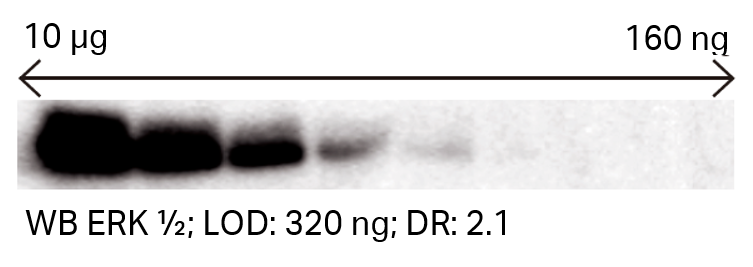
|

|
- *1:感度、発光時間は実験条件によりかわることがあります。
- *2:PVDFメンブレン使用時の目安
- *3:Amersham™ Hybond™ LFP PVDFメンブレン使用時の目安
- *4 最良の結果を得るためにはサンプルごとに条件検討を行って至適抗体濃度を決定する必要があります。
LOD = Limit of Detection/DR = Detection Range

二次抗体の選び方
目的タンパク質に結合した一次抗体を検出するには、標識された二次抗体が必要です。一次抗体を作製させた動物種を確認し、実験系や検出方法にあわせた標識を選択します。下記フロー図から最適な二次抗体の標識の種類をお選びください。
次に、製品情報から一次抗体を作る際に免疫した動物種を元に最適な二次抗体をお選びください。
HRP 標識ニ次抗体
- ECL™ / ECL™ Prime / ECL Select™を用いたウェスタンブロッティング検出に最適
- 高い種特異性
Whole Ab は抗体全体、F(ab)'2 Fragment は結合部位だけが含まれる製品です。一般的にF(ab)'2 Fragment のほうが非特異結合の原因となる領域が少ないためバックグラウンドが低くなるといわれています。ウェスタンブロッティングでは結果はほとんど変わりませんのでどちらをお使いいただいても構いません。
製品情報
| 製品名 | 一次抗体の動物種 | 二次抗体の動物種 | 包装 | コード番号 |
|---|---|---|---|---|
| Anti-GST HRP Conjugate | - | 75 μl | RPN1236 | |
| Anti-Mouse IgG, HRP-Linked Whole Ab Sheep | マウス | ヒツジ | 1 mL 100 μl |
NA931-1ML NA931-100UL |
| Anti-Mouse IgG, HRP-Linked F(ab')2 Fragment Sheep | マウス | ヒツジ | 1 mL | NA9310-1ML |
| Anti-Human IgG, HRP-Linked Whole Ab Sheep | ヒト | ヒツジ | 1 mL | NA933-1ML |
| Anti-Rabbit IgG, HRP-Linked Whole Ab Donkey | ウサギ | ロバ | 1 mL 100 μl |
NA934-1ML NA934-100UL |
| Anti-Rabbit IgG, HRP-Linked F(ab')2 Fragment Donkey | ウサギ | ロバ | 1 mL | NA9340-1ML |
| Anti-Rat IgG, HRP-Linked Whole Ab Goat | ラット | ヤギ | 1 mL | NA935 |
| Anti-Rat IgG, HRP-Linked F(ab')2 Fragment Goat | ラット | ヤギ | 1 mL | NA9350 |
| Anti-Mouse IgG, HRP-Linked Whole Ab Sheep* | マウス | ヒツジ | 1 mL | NXA931-1ML |
- この抗体の力価はIgG に対してのみ評価を行っています。
- IgG 以外のクラス(IgM, IgE IgA など)に対しても弱い反応性を示す可能性がありますが、IgG 以外の検出には適していません。
*交差性のチェックは行っていません。スクリーニングに適しています。
蛍光多重検出用二次抗体
- 複数の目的タンパク質の同時検出
- 抗体除去・リプロービングが不要ーサンプルのロスを防ぎ、実験の手間を削減
- 広いダイナミックレンジ、高い直線性による優れた定量性
- 安定した蛍光持続時間によりくり返し検出が可能
- 簡便なプロトコール
※検出原理は「ECL™検出試薬の検出原理」をご参照ください。
製品情報
| 製品名 | 一次抗体の動物種 | 二次抗体の動物種 | 包装 | コード番号 |
|---|---|---|---|---|
| ECL Plex™ goat-α-mouse IgG-Cy3 | マウス | ヤギ | 150 μg 600 μg |
PA43009 PA43010 |
| ECL Plex™ goat-α-rabbit IgG-Cy5 | ウサギ | ヤギ | 150 μg 600 μg |
PA45011 PA45012 |
| ECL Plex™ goat-α-mouse IgG-Cy5 | マウス | ヤギ | 150 μg 600 μg |
PA45009 PA45010 |
| ECL Plex™ goat-α-mouse IgG-Cy2 | マウス | ヤギ | 150 μg 600 μg |
28901108 28901109 |
| ECL Plex™ goat-α-rabbit IgG-Cy2 | ウサギ | ヤギ | 150 μg 600 μg |
28901110 28901111 |
| ECL Plex™ goat-α-rabbit IgG-Cy3 | ウサギ | ヤギ | 150 μg 600 μg |
28901106 28901107 |
| Amersham™ CyDye™ 700 goat-anti-mouse | マウス | ヤギ | 0.1 mg 0.5 mg |
29360784 29360785 |
| Amersham™ CyDye™ 700 goat-anti-rabbit | ウサギ | ヤギ | 0.1 mg 0.5 mg |
29360786 29360787 |
| Amersham™ CyDye™ 800 goat-anti-mouse | マウス | ヤギ | 0.1 mg 0.5 mg |
29360788 29360789 |
| Amersham™ CyDye™ 800 goat-anti-rabbit | ウサギ | ヤギ | 0.1 mg 0.5 mg |
29360790 29360791 |
ビオチン標識二次抗体
- イムノディテクション、ELISA、in situハイブリダイゼーションに最適
- 高い種特異性
製品情報
| 製品名 | 一次抗体の動物種 | 二次抗体の動物種 | 包装 | コード番号 |
|---|---|---|---|---|
| Anti-Mouse Ig(Whole Ab) Sheep | マウス | ヒツジ | 2 mL | RPN1001-2ML |
| Anti-Human Ig(Whole Ab) Sheep | ヒト | ヒツジ | 2 mL | RPN1003-2ML |
| Anti-Rabbit Ig(Whole Ab) Donkey | ウサギ | ロバ | 2 mL | RPN1004-2ML |
| Anti-Rat Ig(Whole Ab) Sheep | ラット | ヒツジ | 2 mL | RPN1004-2ML |
| Anti-Goat / Sheep Ig(Whole Ab) Donkey* | ヤギ/ヒツジ | ロバ | 2 mL | RPN1025-2ML |
- この抗体の力価はIgG に対してのみ評価を行っています。
- IgG 以外のクラス(IgM, IgE IgA など)に対しても弱い反応性を示す可能性がありますが、IgG 以外の検出には適していません。
*スクリーニングに適しています。
参考:二次抗体の標識・検出方法まとめ
HRP で標識する化学発光が一般的です。そのほかにも蛍光物質で標識する蛍光標識、DAB などの発色物質で検出する発色法、放射性同位体で標識するRI 標識などがあります。
■酵素標識
ホースラディッシュペルオキシダーゼ(HRP)やアルカリフォスファターゼ(AP)などの酵素で標識する方法です。発色や化学発光、化学蛍光による検出が行えます。
ECL™、ECL™ Prime、ECL Select™は抗体に標識されているHRP 酵素により基質が酸化され、その際に発光する光をX 線フィルムやCCD イメージャーなどで検出する化学発光検出を用いています。
発色法は抗体に標識されている酵素により基質が酸化され、その際の発色を検出する方法です。メンブレン上に着色されたバンドが目視で確認できます。発色法には一般的にDAB が用いられますが、感度は化学発光よりも低くなります。DAB には毒性があるため、取り扱いには注意が必要です。
また、メンブレンに色がつくため、メンブレンを再利用して再度別の抗体で反応する際(抗体除去・リプロービング)に不便です。
■蛍光標識
二次抗体を蛍光物質で標識する方法です。定量性が高く、バンドもシャープになります。光を増幅できないので、抗体量が多めに必要になるほか蛍光を検出するためのイメージャーが必要となります。ECL Plex™はこの標識方法を用いています。
■RI 標識
二次抗体をRI で標識する方法です。X 線フィルムに感光して標的タンパク質のバンドを検出します。放射性同位体を扱うための特別な施設が必要になります。
■ビオチン標識
ビオチン標識した二次抗体と、HRP 等で標識したストレプトアビジンを用いて反応を行います。ビオチンとストレプトアビジンが強く結合することを利用した反応系です。二次抗体に複数のビオチン標識をすることでシグナルが増幅され、感度が上がります。
以上、それぞれの標識方法の検出方法、特徴などを(表1)にまとめました。
表1.二次抗体の標識・検出法まとめ
| 二次抗体の標識 | 検出法 | 検出試薬 | 感度 | 安全性 | 簡便 | コスト | |
|---|---|---|---|---|---|---|---|
| 酵素標識(HRP、AP など) | 発色 | メンブレン上の発色 | DAB、BCIP/NBT など | 低 | 〇 | 〇 | 〇 |
| 化学発光 | X線フィルム CCDイメージャー |
ECL™ ECL™ Prime ECL Select™ |
中 - 高 | ◎ | 〇 | 〇 | |
| 化学発光 | 蛍光イメージャー (CCDイメージャー) |
EFC ECL™ Prime |
中 - 高 | ◎ | 〇 | 〇 | |
| 蛍光標識(Cy3、5 など) | 蛍光 | 蛍光イメージャー | ECL Plex™ | 中 - 高 | ◎ | ◎ | 〇 |
| RI 標識 | β線 | X線フィルム RI イメージャー |
ー | 高 | △ | △ | △ |
標識ストレプトアビジン
|
ビオチン | 検出法、基質、感度、安全性、簡便、コストなどは上記(ストレプトアビジンの標識方法)に準じます。 | |||||
| ビオチン標識 | 標識ストレプトアビジンを用いて検出。 検出法、検出試薬、感度、安定性、簡便、コストなどはストレプトアビジンの標識方法によって上記に準じます。 |
||||||
検出とは
メンブレン上のタンパク質が発するシグナルをフィルムや検出システムを使って可視化する作業
検出の原理
検出方法の種類と特徴、検出後のデータの評価についてご紹介します。
化学発光の光を捕捉して可視化する方法には、X 線フィルムを使用する方法と、検出機器を用いる方法の二種類があります。蛍光検出には蛍光試薬で使用している蛍光色素にあわせた蛍光イメージャーが必要です。それぞれの特徴を(表1)に示しました。
検出方法の種類と特徴
CCD イメージャーによる検出(化学発光)
X 線フィルムによる検出と比較した場合、検出時に現像試薬の調製等の必要がないため簡便に検出を行えます。検出結果がデジタルデータとして取り込まれるため、データの保管にも優れています。定量解析では検量線を引くあるいはバンドの濃さを調べるためにゲル画像をデジタル化する必要がありますが、画像解析ソフトがインストールされているCCD イメージャーでは、得られたデジタルデータから直接バンドの濃度を算出、解析することができます。
最新のAmersham™ ImageQuant™ 800は、新しい検出モード、SNOW(Signal-to-Noise Optimaization Watch)により、広いダイナミックレンジでの検出が可能です。
蛍光スキャナー(蛍光、化学蛍光、機種によっては化学発光検出も可能)
メンブレンをスキャン部分にセットするだけで簡便に検出を行えます。検出結果がデジタルデータとして取り込まれるため、データの保管にも優れています。定量解析では得られたデジタルデータから直接バンドの濃度を算出、まま解析することができます。
蛍光検出には、使用する蛍光色素にあわせた励起光、蛍光フィルターが必要なので、あらかじめ対応する蛍光色素を確認しておくことが必要です。
最新のAmersham™ Typhoon™ scannerでは、機能としてPre-Scanが加わり、蛍光撮影時の最適なPMT電圧値を自動的に算出する事が可能です。
X 線フィルムによる検出(化学発光)
X 線フィルムはもっともオーソドックスな方法で、写真現像に使用する暗室・試薬・器具があれば、特別な機器を必要とせず高感度での検出ができます。
X 線フィルムは特別な機器が必要にならないというメリットがある反面、検出できる光量の範囲(ダイナミックレンジ)が狭く、強い光が発せられたときにすぐに検出限界に達してしまう欠点もあります。そのため、定量実験を行う際には光量が検出限界に達しない範囲内に収まるようサンプル量や抗体量の調整が必要です。さらに検出したタンパク質のバンドの濃さを数値化するには、デンシトメーターで測定するか、スキャナーなどでスキャンした後、画像解析ソフトで解析を行います。
X 線フィルムはわずかな光でも感光するので取り扱いは、暗室のような暗所で行う必要があります。ただし、ある波長以上の赤色光には感光しないので、セーフティライトあるいは暗室用ペンライト、 Hypertorch(RPN1620)の点灯下であれば目視で確認しながらの操作ができます。
検出後のデータの評価
理想的なバンドはシャープなシングルバンドになっていて、バンドの周り(バックグラウンド)とのコントラストがはっきりしているバンドです(下図 a)。一方、再度行う必要があるものはバックグラウンドが真っ黒でバンドがよく見えない(b)、バンドが団子状になっている(c)、エキストラバンドが出ている(d)、バンドの中に白く抜けている(e)場合などです。

Amersham™ ImageQuant™ TL (IQTL)による画像解析
検出データの評価後、バンド定量解析等が必要な場合は、解析ソフトウェアAmersham™ ImageQuant™ TL (IQTL)をご利用ください。画像の分析と定量化を簡単に行う事ができます。
抗体反応のコツ
抗体濃度の至適化
ウェスタンブロッティングで最良の結果を得るためには至適抗体濃度を設定することが重要です。抗体濃度が低すぎるとバンドが見えない、抗体濃度が高すぎるとバックグラウンドが高い、エキストラバンドが見えるといったトラブルが起こります。ここでは抗体濃度がはっ きりしない場合の検討法をご紹介します。
※本文中の1:100 等の数値は抗体の希釈率を示します。1:100 の場合は抗体1 容量に対し100 容量のバッファーで希釈するという意味です。
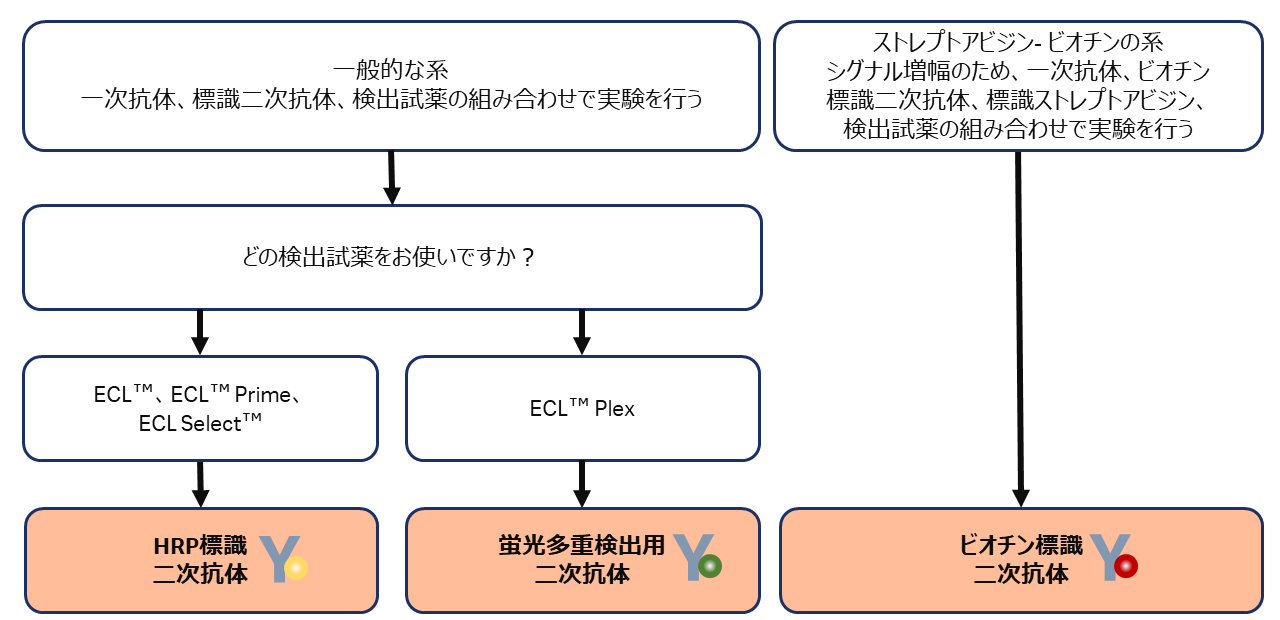
ドットブロット/スロットブロットを用いた至適抗体濃度の検討
電気泳動やブロッティングの操作をせずに、メンブレンに直接サンプルを添加し抗体反応、検出を行う実験をドットブロットと呼びます。(図6)のような点状の画像が得られます。
スロットブロットはドットブロットと同じ目的で使用される手法です。専用の装置(図8)の中にサンプルを入れておき、吸引して一気にメンブレンに吸着させます。サンプルが多くドットブロット作業中にメンブレンが乾燥してしまう場合などに有効な手法です。(図7)のような細い線状のバンドが得られます。得られたブロット画像で最も適したシグナル強度の濃度を元にウェスタンブロッティングの実験を行います。
一次抗体の力価を調べる時には二次抗体の希釈率を固定して実験を行います。また、二次抗体の力価を調べる時には逆に一次抗体の希釈率を固定します。
力価のはっきりしない一次抗体/抗血清を用いる場合- ECL Select™
ECL Select™は非常に高感度な検出試薬のため、抗体濃度が高いと強いバックグラウンドが表れるので、抗体濃度の至適化が特に重要です。
- ニトロセルロースメンブレン、あるいは親水化処理を行ったPVDFメンブレンを用意します。サンプルをピペットでメンブレン上に垂らし、乾燥させます(図5)。希釈率の異なる一次抗体それぞれに対して1 枚のブロットを用意します。
- ECL Select™用ブロッキングバッファーを調製し、室温で1時間ブロッキングします。(PVDF メンブレンがバッファーをはじくようであれば、再度親水化のため、軽く100% メタノールをくぐらせてからブロッキングを行います。
- 洗浄バッファー(PBS-T あるいはTBS-T)で軽く2 回すすぎを行います。
- 系列希釈した一次抗体溶液中で(例1:10,000、1:25,000、1:50,000、1:75,000、1:100,000。表3 をご参照ください。)、室温で1時間振盪します。
- メンブレンを洗浄バッファーで2回軽くすすいだ後、それぞれ新しい洗浄バッファーで15 分× 1 回、5 分× 3 回洗浄します。
- 希釈した二次抗体溶液中で、室温で1 時間振盪します。二次抗体の希釈濃度はX 線フィルムで10 分間露光する場合、1:200,000 を目安に希釈してください。
- ステップ 5と同じ要領でメンブレンを洗浄します。
- 検出試薬でインキュベート後、フィルムに露光してシグナルを検出します。
力価のはっきりしない一次抗体/抗血清を用いる場合- ECL™ Prime / ECL™ / ECL Plex™
- ニトロセルロースメンブレン、あるいは親水化処理を行ったPVDFメンブレンを用意します。サンプルをピペットでメンブレン上に垂らし、乾燥させます(図5)。希釈率の異なる一次抗体それぞれに対して1 枚のブロットを用意します。
- ブロッキングバッファー(例:5% スキムミルクを含むPBS-0.1% Tween 20(PBS-T))を用い、室温で1 時間ブロッキングします。(PVDF メンブレンでバッファーをはじくようであれば、再度親水化のため、軽く100% メタノールをくぐらせてからブロッキングを行います。)
- 洗浄バッファー(PBS-T あるいはTBS-T)で軽く2 回すすぎを行った後、それぞれ新しい洗浄バッファーで10 分× 1 回、5 分× 2 回洗浄します。
- (表3)を目安に系列希釈した一次抗体溶液中で室温で1 時間振盪します(ECL Plex は1.5時間)。
- ステップ 3と同じ要領でメンブレンを洗浄します。
- 希釈した二次抗体溶液中で、室温で1 時間振盪します。二次抗体の希釈濃度はX 線フィルムで10 分間露光する場合、ECL™ Primeでは1:25,000、ECL™では1:10,000 を目安に希釈してください。
- ステップ 3と同じ要領でメンブレンを洗浄します。
- 検出試薬でインキュベーション後、フィルムに露光してシグナルを検出します。
- 実際のウェスタンブロッティングでは、ゲルからメンブレンに転写されるタンパク質は一般に半分以下であることを考慮して抗体濃度を絞り込みます。
力価のわからない二次抗体を用いる場合- ECL Select™ / ECL™ Prime / ECL™ / ECL Plex™
- 力価のはっきりしない一次抗体/抗血清を用いる場合のステップ 1、2 と同様にドットあるいはスロットブロットとメンブレンのブロッキングを行います。
- 一次抗体を希釈後、室温にて1 時間メンブレンをインキュベートします。
- 力価のはっきりしない一次抗体/抗血清を用いる場合のステップ 3にならってメンブレンを洗浄します。
- (表4)を目安に二次抗体を系列希釈後、室温で各メンブレンを1 時間インキュベートします*。
- メンブレンを洗浄バッファーで2 回軽くすすいだ後、15 分× 1 回、5 分× 3 回洗浄します。
- プロトコールにしたがって、ECL Select™ / ECL™ Prime / ECL™検出試薬とインキュベーション後、フィルムに露光してシグナルを検出します。
*ECL Select™を使用する場合には、希釈率に注意する必要があります。また、二次抗体の希釈倍率を決定する場合は、一次抗体の希釈倍率を固定して二次抗体の至適濃度を検討します。
表3.一次抗体希釈濃度の目安
| メンブレンの種類 | 一次抗体希釈 | |
|---|---|---|
| ECL™ | ニトロセルロースメンブレン | 1:100 ~ 1:1,500 |
| PVDF メンブレン | 1:500 ~ 1:5,000 | |
| ECL™ Prime | ニトロセルロースメンブレン | 1:1,000 ~ 1:10,000 |
| PVDF メンブレン | 1:5,000 ~ 1:20,000 | |
| ECL Select™ | ニトロセルロース・PVDF | 1:10,000 ~ 1:100,000 |
| ECL Plex™ | - | 1:100 ~ 1:5,000 |
表4.二次抗体希釈濃度の目安
| メンブレンの種類 | 二次抗体希釈 | |
|---|---|---|
| ECL™ | ニトロセルロースメンブレン | 1:1,000 ~ 1:10,000 |
| PVDF メンブレン | 1:2,500 ~ 1:15,000 | |
| ECL™ Prime | ニトロセルロースメンブレン | 1:10,000 ~ 1:100,000 |
| PVDF メンブレン | 1:25,000 ~ 1:200,000 | |
| ECL Select™ | ニトロセルロース・PVDF | 1:50,000 ~ 1:500,000 |
| ECL Plex™ | - | 1:1,250 ~ 1:4,000/td> |
1 枚のメンブレンで複数の目的タンパク質を検出する
サンプル中のタンパク質について発現比較を行いたい場合や、サンプルが貴重で実験に制限がある場合は、1 枚のメンブレンから複数のタンパク質を検出することが有効です。特に、多重検出ができる蛍光検出はタンパク質の発現比較に便利です。蛍光検出を行う場合には蛍 光イメージャーが必要です。化学発光検出ではリプロービングや抗体除去を行えば複数のタンパク質を検出できます。
蛍光検出の場合(ECL Plex™)
1 枚のメンブレンから2 種類以上の抗体検出を行う場合に、非常に便利なツールが蛍光検出です。Cy2、Cy3、Cy5 の3 種類の蛍光で標識された二次抗体を使用して蛍光イメージャーなどで検出を行います。3 種類までなら1 度の抗体反応で検出できます。蛍光検出を用いたウェスタンブロッティングでは、以下のような利点があります。
- 1 度の操作で複数の抗体による多重検出が可能(下の実験例参照)
- 泳動パターンに依存せず、各抗体反応シグナルを分離して検出可能
- 定量ダイナミックレンジが広く、精度の高い定量比較が可能
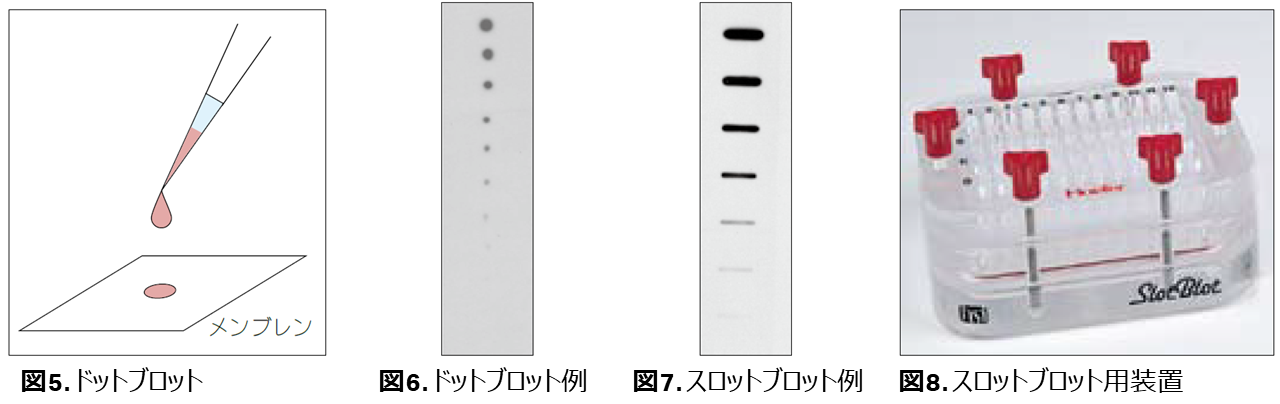
〈実験例〉蛍光検出を用いた多重染色例
低発現のタンパク質phospho-Akt(pAkt)とβ - チューブリンコントロールを同時に検出しました。ダイナミックレンジが広い蛍光検出であればサンプル濃度を気にせず操作できるので大変便利です。
- ターゲット : TGF- βで0、2.5、5、15 分間処理してリン酸化されたT293細胞のphospho-Akt(pAkt)およびβ-チューブリン
- 検出 :Hybond ECL およびTyphoon 9410
- 一次抗体 : rabbit由来ポリクローナルphospho-Akt(Ser 473) およびmouse由来モノクローナル抗β-チューブリン
- 二次抗体 : ECL Plex™ goat-α-rabbit IgG-Cy5 およびECL Plex™ goat-α-mouse IgG-Cy3
化学発光検出の場合(ECL™、ECL™ Prime、ECL Select™)
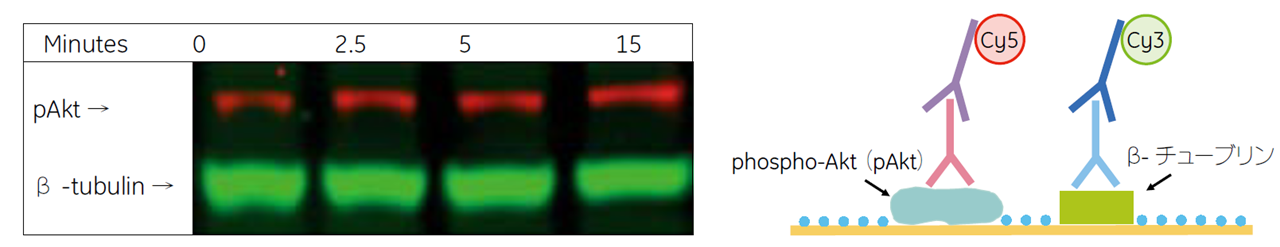
一次抗体が異なる動物種由来の場合
一次抗体が異なる動物種由来の場合は、最初に反応させた抗体をメンブレンから除去する必要はありません。(図9)のように最初の抗体反応で使用した一次抗体に2 回目の二次抗体が結合しないからです。そのため、最初の抗体検出が終わった後、メンブレンをバッファーで洗浄し、ブロッキングからやり直すことでリプロービングが可能です。
図9.リプロービングの流れ
- 最初の検出で用いた二次抗体に結合したHRP は完全に失活しないため、2 度目の検出時にこの抗体由来のシグナルが検出されることがあります。検出されるシグナルを判別しやすくするために、目的タンパク質同士ができるだけ分離できるよう電気泳動時のアクリルアミドゲル濃度を調整します。
- 2 度目の検出で最初のバンドを検出したくない場合にはHRP を失活させる方法もあります。
手順
- 検出後のメンブレンをPBS-T or TBS-T で洗浄します。(10 分間× 2)
- 各検出試薬のプロトコールのブロッキング~検出にしたがい作業します。
一次抗体が同じ動物種由来の場合
一次抗体が同じ動物種由来の場合は、最初に反応させた一次抗体と二次抗体をメンブレンから除去する必要があります(抗体除去、(図10))。抗体除去のステップでは、SDSと還元剤が含まれたバッファーを用い、抗体を変性させます。
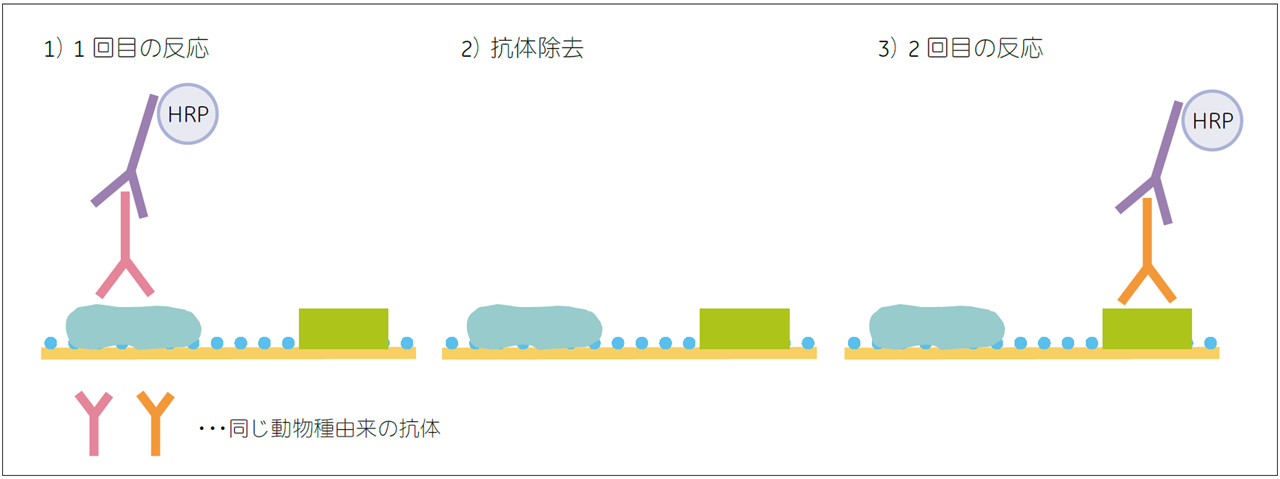
図10.抗体除去の流れ
〈実験例〉抗体除去を行った例
同一メンブレン上で2 種類のタンパク質を検出
actin の検出(a)を行った後にメンブレンから抗体を除去し、二次抗体がはがれたことを確認しました(b)。その後、別の抗体を用いて検出しましたがactin のバンドが出てこなかったため(c-I)、一次抗体もメンブレンから完全に除去できたことが分かりました。また、tublin も問題なく検出できました(c-I)
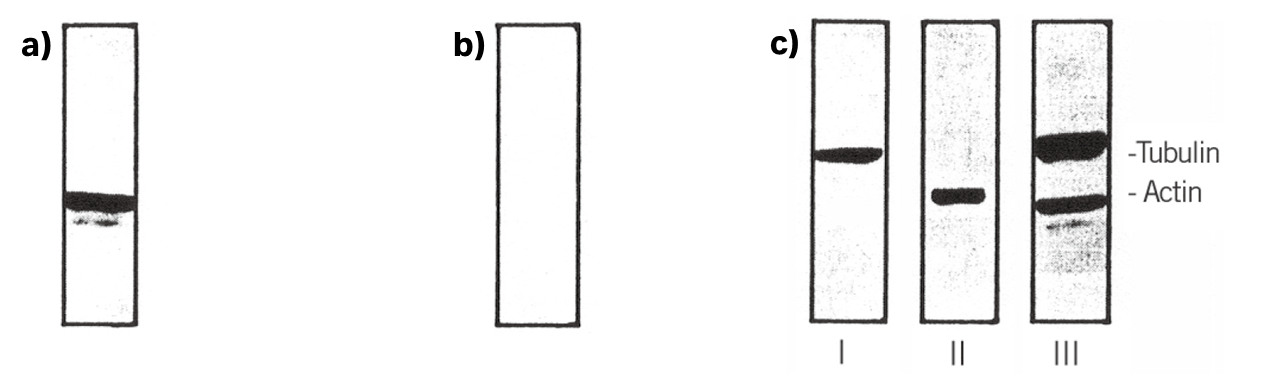
- a)
ラット腎臓抽出液を電気泳動し、ブロッティング後ECL™検出しました。
一次抗体:mouse monoclonal antiactin
二次抗体:HRP-conjugated antimouse IgG
フィルム:Hyperfilm
露光時間:15秒間 - b)
a)のメンブレンから抗体を除去し、再度ECL を反応させて抗体がはがれたことを確認しました。
フィルム:Hyperfilm
露光時間:1分間 - c)
- I:a)のメンブレンを抗体除去後、mouse monoclonal anti-β tubulinとHRP-conjugated anti-mouse IgG でβ tubulinを検出しました。
- II: a)のメンブレンのactin を再検出
- III:位置確認のためにβ tubulin とactin を同一メンブレン上で検出
- タンパク質を厳しい条件にさらすことになるので、メンブレン上のほかのタンパク質も除去(図11)されたり変性による影響を受けます。検出感度の低下やバックグラウンドの上昇を伴うため、貴重な抗体を用いる検出や発現量の少ないタンパク質の検出、目的タンパク質と抗体の親和性が弱い組合せから検出を行います(表5) 。
- 抗体除去を行う場合はタンパク質の吸着度がより高く物理的強度にも優れたPVDF メンブレンを使用します。
- メンブレンが乾燥すると、メンブレンから抗体を除去しにくくなります。操作中は、メンブレンが乾かないように特に注意します。別の日に抗体反応を予定している場合には、湿らせた状態で冷蔵保存します。
- ECL™ Primeによる化学蛍光検出で複数の抗体反応を検出する場合には、最初の抗体反応で残留する蛍光シグナルを抑えるため、抗体除去ステップを行う前に100%アセトニトリルで10 分間インキュベートします。
- 抗体除去が不完全で、最初の抗体由来の偽シグナルが検出される場合は、抗体除去処理時のインキュベーション温度を70 ℃に上げることで改善されることがあります(さらに厳しい条件になるため、目的タンパク質への影響も考慮が必要です)
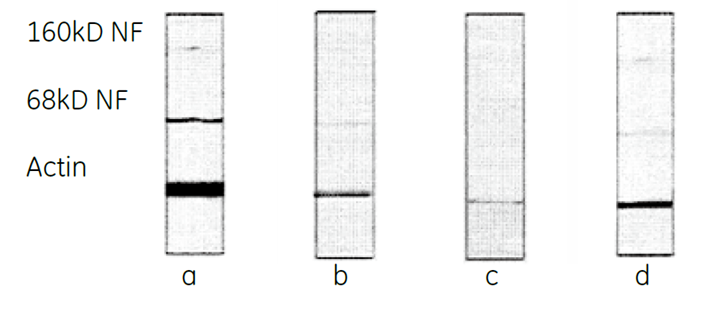
- a - ブロッティング後、直接的に3抗体を同時検出。フィルムに1分間露光。
- b -剥離処置後の反復検出。フィルムに1 分間露光。
- c - 2 度の剥離処置後の2 度目の反復検出。フィルムに1 分間露光。
- d-図1cの反復を5分間フィルムに露光。
図11.反復検出によるタンパク質の消失例
ラット脳のホモジェネートを3 種類の抗体を用いてウェスタンブロッティングを行いました(a)。その後抗体除去バッファーで抗体をすべて取り除き、フィルムa と同じ条件で検出しました(b)。さらに再度、抗体除去バッファーで抗体を除去し検出しました(c、d)。この結果からリプロービングの作業の途中でサンプルが消失することがお分かりいただけます。
表5.検出順序を決定するためのアプローチ
| 方法1 | 方法2 | 方法3 | 方法4 |
|---|---|---|---|
|
抗原量がどちらも十分あり抗体との親和性も変わらない場合
まずどちらかの抗原を検出 抗体除去 残りの抗原を検出 |
抗原量がどちらも十分あり抗体との親和性が異なる場合
まず親和性の低い抗原から検出 同左 最高の親和性をもつ抗体で抗原を検出 |
1つは多量で他方は少量な2 つの抗原と等しい親和性の抗体
まず低量の抗原を検出 同左 多量の抗原を検出 |
1つは多量で他方は少量な2 つの抗原で抗体との親和性が異なる場合
まず低量の抗原を検出 同左 多量の抗原を検出 |
準備
- 抗体除去バッファー:2% SDS、100 mM 2-mercaptoethanol、62.5 mM Tris-HCl、pH 6.7
抗体除去は0.2 M glycine, pH 2.8 溶液で室温30 分間、または7M guanidine HCl、50 mM glycine pH 10.8、0.05 mM EDTA、0.1 M KCl、20 mM 2-mercaptoethanol で室温10 分(振盪)でも行えます。
手順
- メンブレンを抗体除去バッファーに浸します。
- 50℃で30 分間振盪します。
前に検出したバンドが検出された場合には70℃でインキュベーションしてください。 - PBS-T or TBS-T で洗浄します。(10 分間× 2)
- 各検出試薬のプロトコールのブロッキング~ 検出にしたがい作業します。
〈実験例〉過酸化水素によるHRPの不活性化
「一次抗体が異なる動物種由来の場合」のように異なる動物種由来の一次抗体を用いて複数サンプルの検出を行う場合には、一度目に反応させた二次抗体のHRP による偽シグナルが検出される場合があります。
リプロービングの際に、最初のバンドが検出されてしまう場合、HRP を失活させることで偽シグナルの検出を防ぐことができます。ここでは、
- HRP標識二次抗体を用いた抗原の標識と検出
- HRPの不活性化
- 最初に検出したタンパク質による妨害のない別のタンパク質の標識/検出
について行った実験を紹介します。
- ラット腎臓溶解液(20 μg/lane)を電気泳動し、Hybond-ECL にエレクトロブロッティングします。
- メンブレンは10%スキムミルクを含むPBS-T(Tween 20 0.1%)で1.5 時間室温でブロッキングを行った後、PBS-T で5 分間× 3 回洗浄します。
-
メンブレンを2つのセクションに切り、別々に処理します。
- メンブレンⅠ:
抗アクチンマウスモノクローナル抗体と抗βチューブリンマウスモノクローナル抗体を各々1:3,000 希釈PBS 中にて1 時間反応 - メンブレンⅡ:
抗アクチンマウスモノクローナル抗体を1:3,000希釈PBS中にて1時間反応
- メンブレンⅠ:
- メンブレンⅠ、ⅡともPBS-T で5 分間× 3 回洗浄します。
-
HRP 標識二次抗体を反応させます。
- メンブレンⅠ:
抗マウスIgG-HRP 標識二次抗体と抗マウスIgM-HRP 標識二次抗体をPBS-T に1:3,000 希釈で30 分反応 - メンブレンⅡ:
抗マウスIgM-HRP 標識二次抗体をPBS-T に1:3,000 希釈で30 分反応
- メンブレンⅠ:
- メンブレンⅠ、ⅡともPBS-0.3% Tween 20 で5 分間× 3 回洗浄します。
- メンブレンⅠ、ⅡともPBS-T で5 分間× 3 回洗浄します。
- ECL で1 分間反応後、ラップに包み、Hyperfilmに30 秒露光します。a)初回の検出
- PBS-T あるいはPBS-0.3% Tween 20 で10 分間× 2 回洗浄し、検出試薬を除去します。
- メンブレンⅡを15% H2O2 in PBS(30% H2O2とPBS を1:1で混合)に30 分インキュベートし、HRPを不活性化します。
メンブレンⅠはPBS 中で一晩保存します。 - メンブレンⅠ、ⅡともPBS-T で5 分間× 3 回洗浄します。
- メンブレンⅡをECL で1 分間反応後、ラップに包み、Hyperfilmに1分露光します。b)HRPの不活性化
- PBS-T で10 分間× 2 回洗浄し、検出試薬を除去します。
- メンブレンⅡを抗βチューブリンマウスモノクローナル抗体1:3,000 希釈PBS-T で30 分インキュベートします。
- PBS-T で5 分間× 3 回洗浄します。
- 抗マウスIgG-HRP 標識二次抗体をPBS-T に1:3,000 希釈で30 分反応させます。
- PBS-0.3% Tween 20 で5 分間× 3 回洗浄後、PBS-T で5 分間× 3 回洗浄します。
- メンブレンⅠ、ⅡをECL で1 分間反応後、ラップに包み、Hyperfilmに1 分露光します。c)リプロービング後の検出
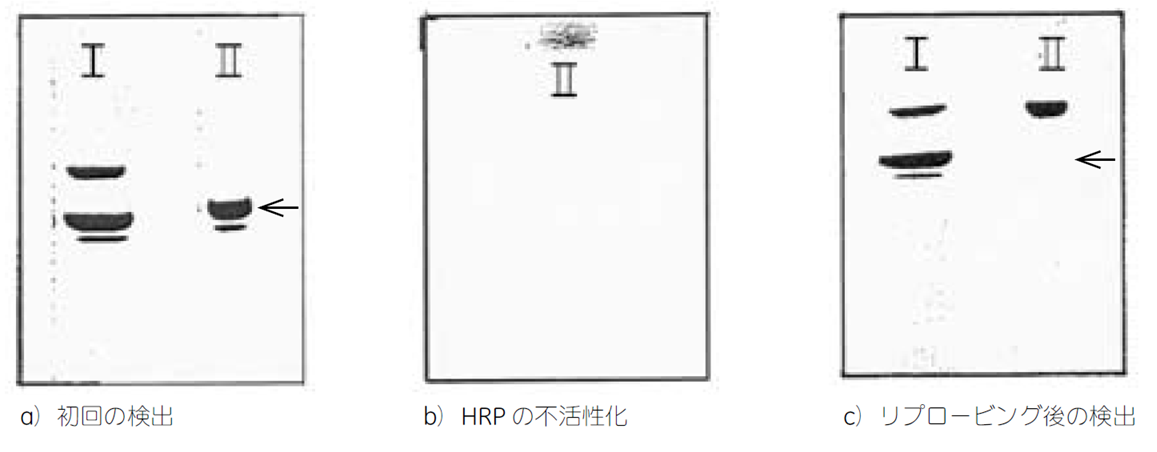
a の←で示したアクチンのバンドがHRP の不活性化(b)の過程を経て消失したことが分かります(c)。HRPの不活性化に必要なペルオキシドの濃度は、HRP の量やインキュベーション時間によって異なります。このサンプルでは15%のペルオキシドが必要でしたが、これによるメンブレンの損傷や処理後の抗体反応への影響は見られませんでした。
この方法を使うことで、検出系を変えることなく、別のタンパク質に関する情報を得ることができました。
参考文献
- ISACSSON, U. and WATERMARK, G., Anal. Chim. Acta, 68, pp.339-362, 1974.
- WHITEHEAD, T. P., et al., Clin. Chem., 25, pp.1531-1546, 1979.
- ROSEWELL, D.F. and WHITE, E.H., Methods in Enzymology,. 57, DELUCA, M.A.(Ed). Academic Press, New York,pp.409-423, 1978.
- MOTSENBOCKER, M.A., J.Biolum. Chemilum., 2, pp.9-16, 1988.
- ELIOR, PELES. and SALAH, S. BACUS., Cell., 69, pp.205-261, 1992.
- XIN-YUAN, FU., Cell., 70, pp.323-335, 1992.
- PAUL, L. STEIN. and HON-MAN, LEE., Cell., 70, pp.741-750,1992.
- KATHLEEN, A. SIEMERS. and RACHEL, WILSON., Science, 260, pp.550-556, 1993.
- T, MEIER. and S, ARNI., Anal. Biochem., 204, pp.220-226, 1992.
- JOHNSTONE, A. and THORPE, R., Immunochemistry in Practice., Blackwell Science Publications, 1982.
- GERSHONI, J. M. and PALADE, G. E., Anal. Biochem., 131, pp.1-15, 1983.
- TOWBIN, H. and GORDON, J., J. Immunol. Meth., 72, pp.313-340, 1984.
- PELUSO, R. W. and ROSENBERG, G. E., Anal. Biochem., 162, pp.389-398, 1987.
- GERSHONI, J. M. and PALADE, G. E., Anal. Biochem., 124, pp.396-405, 1982.
- BURNETTE, W. M., Anal. Biochem., 112, pp.195-203, 1981.
- BITTNER, M., KUPFERER, P. and MORRIS, C. F., Anal. Biochem., 102. pp.457-471, 1980.
- LIN, W. and KASAMATSU, H., Anal. Biochem., 128, pp.302-311, 1983.
- ANDREWS, A.T., Electrophoresis: Theory, Techniques and Biochemical and Clinical Application, Second Edition in Monographs on Physical Biochemistry, edited by A. R. Peacock and W. R. Harrington, Oxford Science Publication,1986.
関連記事
ウェスタンブロッティングとは?
ウェスタンブロッティングは、電気泳動の優れた分離能と抗原抗体反応の高い特異性を組み合せて、タンパク質混合物 から特定のタンパク質を検出する手法です。タンパク質の存在を検出するだけでなくタンパク質の状態確認(リン酸化などの修飾)もできます。リン酸化を介したシグナル伝達機構の解析や狂牛病の二次検査での異常型プリオンの検出などライフサイエンスの様々な分野で、目的タンパク質の検出や解析に利用されています。
電気泳動とは?
ウェスタンブロッティングのはじめのステップである電気泳動をご紹介します。大小さまざまなタンパク質が含まれるサンプルをサイズの違いに並べることで目的のタンパク質を見つけやすくなります。
ブロッティングとは?
電気泳動後のゲルからメンブレンにタンパク質を転写(ブロッティング)する方法をご紹介します。
ウェスタンブロッティング:トラブルシューティング
実際のトラブル写真を掲載して解決策や改善のためのワンポイントをご紹介します。
ウェスタンブロッティング攻略ガイド 改定冊子版
ウェスタンブロッティングの教科書としてたくさんのお客さまからご請求いただいております、最新のECL™試薬や画像解析装置などの情報を更新など盛りだくさんな一冊となっております。
ウェスタンブロッティング攻略ガイド抜粋版PDF
初めて化学発光のウェスタンブロッティングの実験をされる方にも、使っていただけるよう標準プロトコールをご用意しました。
関連製品
Amersham™ ImageQuant™ 800
富士フイルムと共同開発したCCDイメージャーの最新機種。いままでよりもっと簡単にきれいな画像を撮影したい方におすすめです!
Amersham™ Typhoon™ scanner
Typhoon™ FLA 9500シリーズの後継機種で富士フイルム社と共同開発したスキャナータイプ画像解析装置
Amersham™ ECL™ シリーズ
ウェスタンブロッティングに適した化学発光検出試薬、Amersham™ ECL™シリーズです。
Amersham™ QuickStain
Cy5とラベリングバッファーのキットで、SDS-PAGEのバンドの蛍光検出やウェスタンブロッティングのメンブレン上で抗体検出バンドとトータルプロテインの蛍光検出を同時に行うことによりノーマライズすることがが可能となります。
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。

