
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > Pharma Mail |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 第VIII因子の精製プロセス
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Medium | Estimated lifetime (cycles/year)* |
|---|---|
| Sepharose™ 4 Fast Flow | 600 |
| Q Sepharose™ High Performance | 400 |
| SP Sepharose™ High Performance | 400 |
| Superose™ 12 prep grade | 400 |
* Or maximum 3 years.
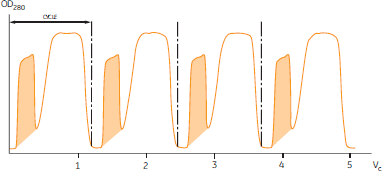
図3. Sepharose™ 4 Fast Flawによる大容量ゲルろ過クロマトグラフィー
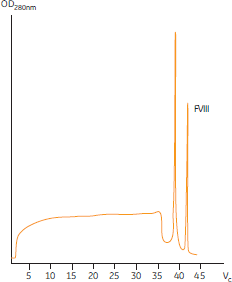
図4. Q Sepharose™ High Performanceによる陰イオン交換クロマトグラフィー
結果および分析
第VIII因子最終製剤は純度が高く、製剤化前の比活性は300 IU/mgとなります。7ページの表1に製剤化前の濃縮液の特性を示します。
第VIII因子プロセスの重要な特長は、独立した2つのウイルス不活化ステップを有することです。すなわち、S/Dテクノロジーによる脂質性エンベロープを有するウイルスの不活化ステップおよび過酷乾熱処理によるエンベロープの有無に関わらないウイルスの不活化ステップです。このウイルスの不活化ステップと、それに加えて2つのイオン交換ステップは、異なるタイプのウイルス除去および不活化に有効です(表9)。脂質エンベロープを有するウイルスもエンベロープをもたないウイルスも共に顕著に減少しています。
| Virus | Q Sepharose™ Fast Flow | SP Sepharose™ Fast Flow | S/D technology | Severe dry heat | Total virus reduction | |
|---|---|---|---|---|---|---|
| IBR | Log10 | 2.9 | 1.6 | < 5.9 | < 8.8 | < 18.7 |
| VSV | Log10 | 3 | 0.95* | < 4.5 | 6.6 | < 15.4 |
| HIV | Log10 | Not done | Not done | < 5.4 | < 4.3 | < 9.7 |
| BVDV | Log10 | Not done | 2.4 | < 5.9 | < 5.0 | < 13.3 |
| Sindbis | Log10 | Not done | Not done | < 5.8 | Not done | < 5.8 |
| Polio | Log10 | 2.2 | 2.4 | Not applicable | < 6.4 | < 11.0 |
| Parsvo | Log10 | 0 | 1.6 | Not applicable | 5.3 | 6.9 |
| HAV | Log10 | Not done | Not done | Not applicable | < 5.2 | < 5.2 |
* Not included in the reduction sum.
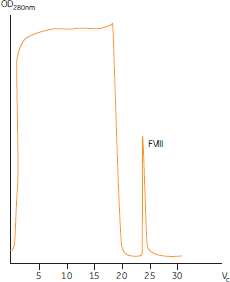
図5. SP Sepharose™ High Performanceによる陽イオン交換クロマトグラフィー
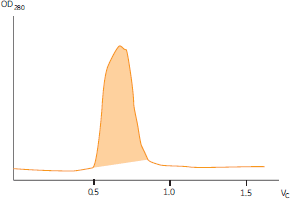
図6. Superose™ 12 prep gradeによるゲルろ過
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva
