|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > Pharma Mail |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 生物学的安全性
最終血漿分画製剤の安全性は最も重要です。ウイルス感染および他の脅威は、臨床的な調査だけでなく、慎重なドナー選択、入念な献血のスクリーニング、ウイルスマーカーに関する製品および中間体の検査によっても減らすことができます。さらに、特定のウイルスクリアランス工程を含むバリデートされた製造方法が要求されています。血液バンクおよび血漿回収センターでのモニタリングによっても安全性が向上します。 FDAや欧州医薬品庁などの規制当局はウイルスおよび微生物不活化に関する新規方法の継続的な研究、および良好な効果が認められた方法の適用を奨励しています。 今日、信頼性および実証されており血漿分画製剤の安全性確保に役立ついくつかの技術があります。すなわち、有機溶媒/界面活性剤テクノロジー(S/Dテクノロジー)、熱処理、カプリル酸処理および低pHによるウイルス不活化です。また、クロマトグラフィーステップおよびナノフィルトレーションもウイルスを除去し、クロマトグラフィーシステムの洗浄、殺菌に使用する化学薬品もまた、微生物汚染やエンドトキシンを削減します。 プリオン感染性海綿状脳症(TSE)はプリオンタンパク質(PrP)として知られている細胞内糖タンパク質の異常アイソフォームの蓄積を特徴とする慢性変性神経疾患です。異常型アイソフォーム(PrPSc)は熱変性およびプロテアーゼ処理に高い耐性を示し、正常型とは異なります。PrPScが感染性のあるTSEの原因であると考えられています。 ヒトにおいて海綿状脳症は、異なる型のクロイツフェルトヤコブ病(CJD)も含みます。ウシ海綿状脳症(BSE)が変異型クロイツフェルトヤコブ病(vCJD)の原因であることを示唆する説得力のある証拠があります。TSEに自然に感染する種を用いた生物材料を医薬品製造に用いる際には慎重なアプローチが必要です。欧州連合官報では、規制遵守に関するリスクアセスメントを行う際に、考慮すべき関連のリスクファクターを特定しています。製造業者はこのガイドを参照するよう勧告が出ています。 ウイルスクリアランス有機溶媒/界面活性剤(SD)テクノロジー*HIV、B型およびC型肝炎ウイルスなどヒト血液に存在するウイルスの多くはエンベロープを有しています(表10)。SDテクノロジーはエンベロープを有するウイルスの不活化においては確立された標準の技術として広く受け入れられています。生物製剤製造においては広く使用されており、卓越した安全記録を有しています。1985年に米国で最初に認可されて以来、SD処理済血漿製剤による脂質エンベロープを有するウイルス感染の報告は一例もありません。 *CytivaではSDテクノロジー利用ライセンスを販売しております。薬剤は含まれません。
SD処理では、溶媒(Tri-N-butyl phosphate[TNBP])および界面活性剤(コール酸ナトリウム、Tween 80またはTriton X100)の混合液を使ってインキュベートします。残留SD薬剤の除去は容易で、特別な装置もほとんど必要ありません。ここで紹介したクロマトグラフィー法においては、第VIII因子およびIgGのプロセスでSD不活化を使用しています。 SDテクノロジーを用いたモデルウイルスの不活化に関する試験結果からも、本方法の有用性が確認されています(表11)。 過酷乾熱処理この方法(80℃、72時間のインキュベーション)は脂質エンベロープの有無にかかわらず広い範囲のウイルスに対して効果があります。実験的にはHIV-1(最大スパイク)では4.3 log以上、牛伝染性鼻(腔)気管炎ウイルス(IBR)では8.3 log以上、およびウシウイルス性下痢ウイルス(BVD)では5.0 log以上減少することが証明されています。エンベロープのないウイルスについても、ポリオおよびA型肝炎ウイルス(HAV)に対して、それぞれ6.4 logおよび5.2 logを超える減少が確認されています。 第VIII因子のプロセスには過酷乾熱処理が含まれています。
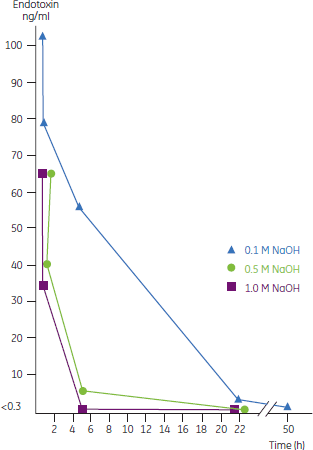
B. Horowitz, Blood Coagulation and Fibrinolysis 5(3) S21-S28 (1994)のデータより 低温殺菌アルブミンプロセスには特殊なウイルス不活化ステップ、60℃、10時間の低温殺菌があり、これは脂質エンベロープの有無に関わらず効果があります。 Q-One Biotech Ltd.(英国)がアルブミンプロセスでのウイルス除去をクロマトグラフィーと組み合わせて検討した結果、5.2 log以上減少しました。検討したウイルスは、エンベロープを有するウイルスとして、BVD、ウシヘルペスウイルス(BHV)-1およびヒト免疫不全ウイルス-1、ならびにエンベロープを有さないウイルスとして、肝炎A型ウイルスです(BVDはC型およびG型肝炎ウイルスのモデルとして使用)。 同試験では、アルブミンのプロセスにおいて2種類のイオン交換ステップと低温殺菌ステップを組み合わせるとBHV、HIVおよびエンベロープのないマウス脳心筋炎ウイルス(EMC)において沈殿ステップと比較して6.4 logを超える除去ファクターが得られることも示されました(EMCはA型肝炎ウイルス[HAV]のモデルとして使用)。 ヒト血漿からアルブミン製剤を製造する企業にとって、低温殺菌は主要な不活化ステップとなっています。 クロマトグラフィークロマトグラフィー工程もまた、ウイルス除去、不活化に有効です。第VIII因子プロセスにおいては、第VIII因子とQ SepharaseおよびSP Sepharaseイオン交換担体の結合がたいへん強固であるため、混入物質を洗い流すことも可能となり、これらの工程がウイルスクリアランスに役立っています。Q SepharaseはIBR、水疱性口内炎ウイルス(VSV)およびポリオウイルスを除去し、一方でSP SepharaseはIBR、VSV、ポリオおよびパルボウイルスを除去することが示されています。 CSL(オーストラリア)は、アルブミンプロセスにおいてSephacryl™ S-200でのゲルろ過ステップがHAVの4.6 log以上のクリアランスが得られることを示しました。このグループは第IX因子製造においても、SD処理による不活化とクロマトグラフィーによるクリアランスを用いて、ウイルス不活化試験で同様の成功を収めています。 洗浄および殺菌NaOHはクロマトグラフィーシステム内に徐々に蓄積するウイルス、細菌および酵母の不活化に使用する試薬としてよく知られています。(この試薬は、強力に結合したタンパク質や核酸も除去できるため、担体寿命の延長やクロマトグラフィー性能の最適化にも有用です。) 装置からのエンドトキシン除去エンドトキシンもまた、血漿分画製剤の安全性の脅威となります。簡単かつ有効な不活化手段があります。 エンドトキシン不活化の最善方法は精製プロセスに用いるクロマトグラフィー担体および装置をNaOHで洗浄、殺菌を行うことです。 NaOHの使用は、カラムに充填されている担体からの結合タンパク質および核酸の除去(定置洗浄)、およびサイクルを重ねるにしたがって蓄積した細菌、酵母およびウイルスの不活化(サニタイゼーション)用として広く認められています。詳細については後述部分を参照してください。 溶液中の非常に高レベルのエンドトキシンの不活化においてもNaOHは極めて有効です(図23)。より高い2種類の濃度(0.5 Mおよび1.0 M)を使用することで、エンドトキシン除去に必要な処理時間を顕著に短縮することができるのは、重要なポイントです。 Q Sepharase Fast Flow を充填したBioProcess™クロマトグラフィーシステムにおけるエンドトキシンチャレンジ試験を行い、1M NaOHをわずか1時間循環させただけでシステムから効率よくパイロジェンを除去できることを確認しています。 ウイルス除去表12にまとめたように、Q-One Biotech Ltd.は0.1 Mおよび0.5 M NaOHのウイルス不活化について8種類の異なるウイルスを用いて経時的に調べています。極めて耐性の高いエンベロープを持たないイヌパロウイルス(CPV)およびシミアン・ウイルス40(SV-40)も、速やかに不活化されています。 細菌、酵母の除去表14に示すように、細菌や酵母の除去においてもNaOHが非常に有効であり、この効果は濃度、処理時間および温度に依存しています。胞子はこの条件では完全に不活化できませんが、医薬品の製造管理および品質管理に関する基準(GMP)を遵守すれば、製造環境からその存在を排除できます。 近年、技術の進歩により、多くのクロマトグラフィー担体の高濃度のNaOHに対する耐性は向上してきましたが、それでも中には殺菌に通常使用する濃度に耐えることができない担体がいくつかあります。このような場合は、低濃度のNaOHにエタノール(最終濃度20%)を加えることよって、良好な不活化が可能です。表14に、酵母C. albicansにおけるその効果を示します。
a) Virus titers expressed in TCID50 (Tissue Culture Infective Dose) units for all viruses except BHV and MLV (expressed in plaque forming units - pfu). NaOH使用の実際NaOHには抗菌剤としての有効性に加えて、多くの利点があります。他の殺菌剤と比較して安価で使用も容易です。たとえば、クロマトグラフィーからのNaOHの除去は、単にライン中のpHおよび伝導度を測定することで容易に確認できます。 NaOH使用を検討するに当たり注意すべきことには、その使用濃度、時間および温度に対するクロマトグラフィー担体、カラムおよび付属装置の適合性があります。NaOHに対する耐性の重要なファクターとして、担体に関しては官能基、結合に使用した化学反応、およびベースマトリックスのアルカリ条件に対する安定性が挙げられます。 なお高濃度のNaOHは金属および皮膚を腐食する可能性があります。 生物学的安全性対策の実例ここに述べてきた生物学的安全性対策のうち、いくつかの効果は第VIII因子製造中に使用されるウイルス不活化について分析することで確認できます。ここでは、2つの独立した方法(SDテクノロジーおよび過酷乾熱処理)に2種類のイオン交換ステップ(Q Sepharase Fast FlowおよびSP Sepharose™ Fast Flow)を組み合わせて、非常に有効な総ウイルス除去を達成しています。第VIII因子の精製プロセスの表9で、このウイルス除去/不活化についてまとめています。
* per ml
* for reduction to below detection limit of < 3 organisms/mL. お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva