DIGE 道場 第2回
こんなにすばらしい!2D-DIGE法
第2回 もくじ
- 二次元電気泳動に対する誤解と2D-DIGE
- 2D-DIGEの魅力
- 2D-DIGEが可能にした「レーザーマイクロダイセクションからのプロテオーム解析」(本ページ)
- 最後に
Dr. 近藤のコラム
 コラム2D-DIGE は本当に高いのか? “大事(DIGE)なお財布の話”
コラム2D-DIGE は本当に高いのか? “大事(DIGE)なお財布の話”
3. 2D-DIGEが可能にした実験例
~レーザーマイクロダイセクションからのプロテオーム解析~
●困難を極めたレーザーマイクロダイセクションからのプロテオーム解析
2D-DIGE法ではレーザーマイクロダイセクションで得られる少数の細胞から抽出したタンパク質からでもプロテオーム解析が可能である*1。
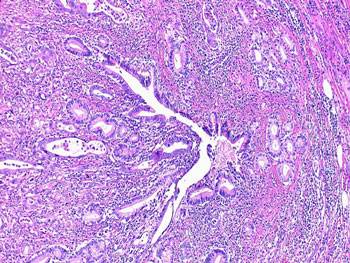 図6 膵がん腫瘍組織のHE画像
図6 膵がん腫瘍組織のHE画像
腫瘍細胞はこのうちわずかしか存在しない。これをぐちゃぐちゃに混ぜてサンプリングしたのでは、2D-DIGE法でも何でも定量的比較解析は不可能。程度の差はあるものの、同様のことはあらゆる悪性腫瘍の腫瘍組織について言える。
腫瘍組織を用いたプロテーム解析ではレーザーマイクロダイセクションは必須である。腫瘍組織にはさまざまな細胞が含まれている。図6は膵がん組織の切片をHE染色した標本の写真であるが、ここには腫瘍細胞のみならず線維芽細胞、炎症細胞、脈管を構成する細胞などが含まれている。それぞれの細胞が独特のプロテオームをもっていることから、これらをまとめてすりつぶしたのでは正確なプロテオーム解析は期待できない。腫瘍細胞のプロテオーム解析のためには腫瘍細胞を、間質細胞のプロテオーム解析のためには間質細胞を、タンパク質抽出の前にそれぞれ回収することが必要である。
そのために用いられる技術がレーザーマイクロダイセクションである。レーザーマイクロダイセクションでは、顕微鏡下で組織切片を観察しながら目的の細胞だけをレーザーを用いて回収する。ゲノムやトランスクリプトームの分野ではルーチンに用いられている技術である。
プロテオーム解析の分野でもレーザーマイクロダイセクションの重要性は早くから認識されており、二次元電気泳動法を用いた実験に応用されている。しかしながら、タンパク質スポットの検出に銀染色を用いていたため、1回の実験ごとにたくさんのタンパク質、言い換えれば細胞が必要だった。レーザーマイクロダイセクションでは一度にたくさんの細胞を回収することはできない。結果的に、プロテオーム解析に必要なだけの細胞を回収するのには膨大な実験時間が必要とされていた。
●超高感度 サチュレーションダイの登場
筆者は2001年にアマシャムバイオサイエンス社(現Cytiva)の方から超高感度の蛍光色素のことを知らされた。当時はすでにMinimal Labelling Dye(ミニマルダイ)が市販されていたのだが、さらに別のタイプの蛍光色素を市販するかどうか決めかねているということだった。
その話を聞いたときにまず考えたのがレーザーマイクロダイセクションへの応用だった。レーザーマイクロダイセクションのプロテオーム研究への実用化を妨げているのは銀染色の感度なのだから、超高感度の蛍光色素を使えば解決できるのではないかと思った。
実験内容を説明し、英語で計画書を書き、ようやくサンプルを入手することができた。難航したのは凍結切片の染色方法だった。初めは、通常の組織染色に使われるHE染色を試したのだが、まったくうまくいかなかった。染色の段階ごとにタンパク質を抽出し、どの段階で実験がうまくいかなくなるかを確認したところ、エオジンがまずいことがわかったので、結果的にはエオジンを除くプロトコールとした。解析に十分な二次元電気泳動の画像を取得するためには、厚さ10 µm×面積1 mm2程度の凍結切片があれば良いこともわかった。細胞の数に換算すると組織型にもよるがだいたい3,000個以下となる。従来より一桁以上少ない数である。
この超高感度の蛍光色素を使用することで初めてレーザーマイクロダイセクションはプロテオーム解析において実用的なツールになった。このプロトコールをまとめて論文*1にすると同時に、アマシャム バイオサイエンス社(現Cytiva)には内容を報告した。その結果を受けて市販されるようになったのが今のSaturation Labelling Dye(サチュレーションダイ)である。
筆者のラボでは、手術検体を用いるプロテオーム解析では、保管状況のために組織像がよく観察できないような場合を除いて全例レーザーマイクロダイセクションを用いて特定の細胞を回収してからタンパク質を抽出することにしている。プロトコールの詳細は次回以降記載するが、午前中に切片を作製し、午後からレーザーマイクロダイセクションにとりかかるというスケジュールで実験を行っている。
●わずか3,000細胞から発現差異解析が可能
2D-DIGE法以外の手法を用いてレーザーマイクロダイセクションからプロテオーム解析を行ったという報告はいくつか存在する。しかしながら、よくよく論文を眺めると、以下のような内容であることが多い。
- 使用している細胞数あるいはタンパク質量がかなり多い(レーザーマイクロダイセクションにかなりの時間をかけているか、細胞を雑に回収している)
- パターンを見ているだけでタンパク質同定が行われていない
- 観察できるタンパク質の種類が少ない(数100種類程度)
2D-DIGE法の場合、上述のようにかなり少ない数の細胞(>3,000 cells)から発現差異解析が可能である。また、タンパク質の同定も可能である。同定実験はレーザーマイクロダイセクションで回収した細胞を用いて行うのではない。すりつぶした組織から抽出したタンパク質(100 µg)を泳動してスポット分取ゲルを作製し、分取ゲルの画像を解析用のゲルの画像と解析ソフトウェアでマッチさせる。そして同定実験のためのタンパク質は分取ゲルから回収するようにする。タンパク質スポットを確実に一致させたければ、分取用サンプルと解析用サンプルをCy3、Cy5で標識して一枚のゲルで泳動すればよい(再現性がよいので通常はその必要はないのだが)
レーザーマイクロダイセクションで回収された細胞から観察できるタンパク質スポットの数は、普通に2D-DIGE法を行った場合と変わらず、Ettan™ Daltならば2,000以下であとはゲルサイズに従って増えていく。筆者のラボではすでに何100検体もの腫瘍組織を対象にレーザーマイクロダイセクションを用いてプロテオーム解析を行ってきた。レーザーマイクロダイセクションをプロテオーム解析に応用した報告はいくつか存在するが、レーザーマイクロダイセクションが安定してルーチンに用いることができるプロトコールは2D-DIGE法以外には今のところ存在しない(注7)。
筆者の経験からマイクロダイセクションを取り上げたが、極めて微量しか得られないタンパク質サンプルを扱っている研究者の方には、プロテオーム解析をあきらめる必要はまったくない、と言いたい。サチュレーションダイが、それを可能にしてくれるのだから。
レーザーマイクロダイセクションは極微量しかサンプルが得られない実験の代表である。他にも、たとえば初代培養細胞から得られるタンパク質サンプル、多次元液体クロマトグラフィーで分画をとったあとのタンパク質サンプルなど、従来の銀染色ではとても解析に値しなかったタンパク質量であっても、サチュレーションダイによって二次元電気泳動法が可能になっていることを強調しておきたい。
次へ 4. 最後に
このページのトップに戻る
DIGE道場トップページへ
注釈
注7:アイソトープを使ってレーザーマイクロダイセクションで得られたタンパク質を標識して二次元電気泳動法で分離するという手法もある*2。3.5μgから二次元電気泳動法が可能ということなので、感度としては2D-DIGE法(サチュレーションラベリング)とほぼ同定である。しかし多数の検体に対してはアイソトープ標識より蛍光色素標識する方がはるかに楽である。
補足 ミニマルダイとサチュレーションダイについての基礎知識
「DIGE定期便 第2号 二種類の蛍光標識法を極める」を参照ください。
参考文献
- Kondo T, Seike M, Mori Y, Fujii K, Yamada T, Hirohashi S. Proteomics ;3(9):1758-66(2003)
- Poznanovic S, Wozny W, Schwall GP, Sastri C, Hunzinger C, Stegmann W, Schrattenholz A, Buchner A, Gangnus R, Burgemeister R, Cahill MA. J Proteome Res. 4(6):2117-25.(2005)

