|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > BIA(生物物理学的相互作用解析) > 相互作用解析の王道 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
実践編-4:フラグメントライブラリーの測定におけるSPR/ITC戦略の実効性と効率的活用法(1)目次
フラグメントスクリーニングのおけるSPR測定の注意点さて、低アフィニティー・低分子量であるフラグメントのSPRスクリーニングにおいて高品質なヒット化合物を得るにはどのような点に特に気をつけるべきでしょうか。答えはいろいろありますが、非特異的吸着(Non-Specific Binding: NSB)を理解することは非常に重要な点です。低アフィニティーであるフラグメントの測定濃度は必然的に高くなります(50 µM~2 mM程度)が、その結果NSBを起こしやすく、特異的相互作用をマスクして偽陽性だらけになってしまう恐れがあるからです。ではどのようにNSBが小さく(Noise)、結合レスポンス(Signal)の大きな(S/Nが高い)良好なスクリーニング系を構築できるのでしょうか。SとNを分けて考えてみましょう。
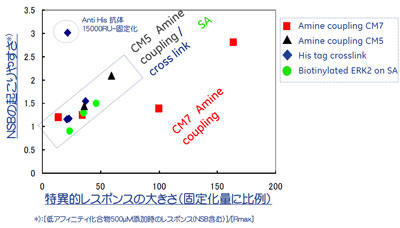
お気づきのとおり1と2はほとんど同じことを言っています。添加濃度を高くするとSが高くなると同時にNも高くしてしまうリスクを負うことになります。また固定化量を大きくするためにアミンカップリング法を適用するとタンパク質の変性が起こしやすくNの上昇を引き起こしがちです。2-cについては少しデータをご紹介した方が良いかもしれません。図1を見てください。これはERK2を標的タンパク質として、各種固定化方法・固定化量とNSBの起こりやすさとの関係を調べたものです。固定化量の大きい方がNSBを起こしやすいことがわかります。
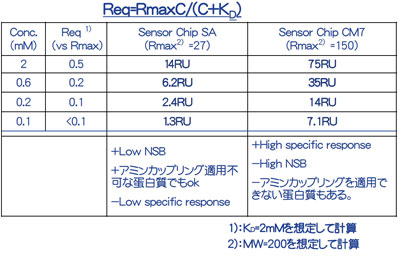
もう一つ、添加濃度についても考えてみましょう。表1は理論式に基づいて各添加濃度に対してどのくらいの大きさの特異的レスポンスが得られるか算出しました。KD<2 mMの選出クライテリアを設定した場合、200 µM程度の濃度を添加すれば装置の感度から十分検出することができ、かつ濃度が高すぎることもないと考えました。
では、どのようなSPRスクリーニング系を構築したら良いかということをまとめます。固定化方法については、アミンカップリング法もアビジン-ビオチンに代表されるようなキャプチャー法もそれぞれにメリット・デメリットがあります。したがって、標的タンパク質によって最適な方法は異なります。しかしながら、装置検出器の感度の向上とともに、より小さなレスポンスをNSBの少ない環境で検出することの有用性は増していくと考えられます。また、両方の固定化手法をともに行い重複選出された化合物は、非常に確からしいヒットがほとんどであったという結果も次回の実験例でご紹介したいと思います。 次へ(選出されたフラグメントのITCを用いた効率の良いヒットバリデーション法とエンタルピーランキング法) 「相互作用解析の王道」について「相互作用解析の王道」は、2009年8月よりバイオダイレクトメールでお届けしています。
バイオダイレクトメールは弊社WEB会員向けメールマガジンです。バイオダイレクトメールの配信をご希望の方は、下記リンク先からご登録をお願いいたします。 関連リンク津本先生の研究内容や論文などはこちら→津本浩平先生の研究室Webサイト お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva