|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > BIA(生物物理学的相互作用解析) > 相互作用解析の王道 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
DSC(示差走査熱量計)によるタンパク質の熱安定性評価(2)大阪大学大学院工学研究科生命先端工学専攻 タンパク質の熱変性の説明を行う前に、タンパク質の熱変性を理解する際に助けとなる幾つかの熱力学的な説明を最初に記述します。 4.タンパク質の熱変性と化学平衡タンパク質が天然状態から変性状態へと変わる過程については、大きく分けて2つの可能性が想定されます。1つは天然状態と変性状態の2つの状態のみで系が構成されており、温度の上昇に伴って2状態のエネルギー差が変化することで変性が進行するという“2状態変性”であり、2つめは温度の上昇に伴い天然状態からわずかにエネルギーが低い状態へと少しずつ遷移し、最終的に変性状態へと移る“多状態変性”です。2状態変性の場合には、全ての温度で天然状態と変性状態の2種類の状態だけが存在し、両者の間には1種類の平衡定数のみが存在することとなります。一方、多状態変性の場合には、各状態間に対して異なる複数の平衡定数が存在することとなります。2状態変性で平衡定数が1種類であれば、天然状態と変性状態の間のエネルギー差は次式によって表せます。 ΔG(T)= -RTlnK(T) (5) ここでRは気体定数、Kは天然状態と変性状態の平衡定数であり、天然状態がタンパク質分子全体に占める比率を[N]、変性状態が占める比率を[D]と記載すると K(T)=[D]/[N] (6) となります。ここで、[N]+[D]=1です。つまり、各温度での天然状態と変性状態のエネルギー差に応じて2つの状態を構成する分子の比率が変化することとなります。従って、熱測定によって各温度における2状態間のエネルギー差が得られれば、それぞれの状態を構成する分子の割合を各温度で知ることが可能です。
各温度のK(T)が分かれば、次のファントホッフの式より変性に必要であった全エンタルピー変化を求めることが可能です。 ΔH/RT2=dlnK(T)/dT (8) なお、このファントホッフ式は次式から導かれ、ここで得たΔHはファントホッフエンタルピー(ΔHvan)と呼ばれます。 dΔG(T)/dT=d[ΔH-TΔS]/dT= -RTlnK(T) (9) ファントホッフエンタルピーは天然状態と変性状態の比率をモニターできる手法であれば、求めることが可能で、しばしば、円偏光二色性(CD)や蛍光測定、などの分光学的手法が用いられます。式(8)から分かるように、変性の温度幅が狭い(温度が変わると平衡定数が大きく変化する)方がΔHは大きな値となることにご留意ください。
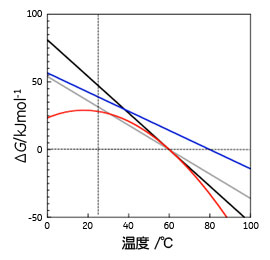
5.2状態で変性するタンパク質の各温度における安定性2状態で熱変性を起こすタンパク質については、熱変性に伴うエントロピー変化とエンタルピー変化をDSC等により知ることが出来れば、 ΔG(T)=ΔH(T) - TΔS(T) (10) により、各温度における天然状態と変性状態の間の自由エネルギー差が分かり、従って、見かけ上変性が起こっていない温度においても天然状態が変性状態と比べてどの程度安定であるかを知ることができます。また、ΔG(T)と式(6)から各温度における2状態の割合を知ることが可能となります。ただし、天然状態が持つ熱容量(CpN)と変性状態が持つ熱容量(CpD)に差がある場合(ΔCpND≠ 0)、ΔHとΔSが温度依存性を持つため、温度の低下に伴って天然状態のエネルギーが変性状態のエネルギーより高くなるケースが生じます。これは以下の式により説明され、視覚的には図4により理解できます。
ΔG(T) =ΔH(Tm)+ΔCp(T - Tm) - T{ΔS(Tm)+ΔCpln[T/Tm]} (13) なお、すでに記載したようにTmはΔGが0となる温度ですので、 ΔH(Tm) = TmΔS(Tm) (14) となります。
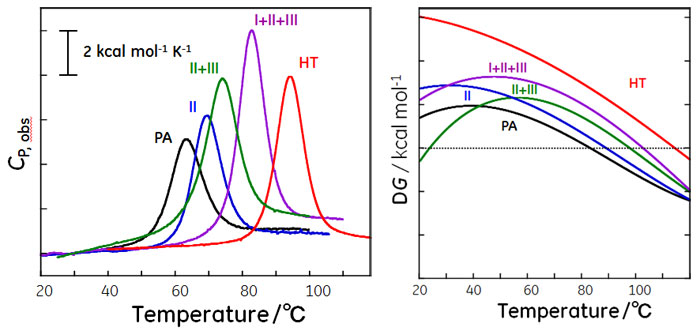
このようにして図5の熱測定の結果から図6に示したように幅広い温度での自由エネルギー変化が得られます。
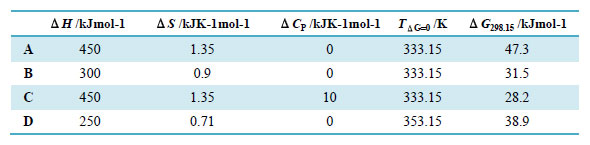
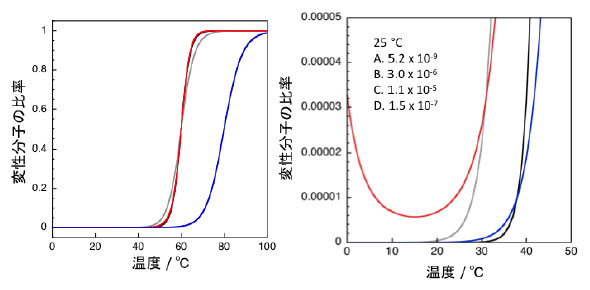
図5は常温菌由来シトクロームに人工的に変異を導入することで変性温度が上昇した例を示しました。概ね、変性温度の上昇に伴いピークの高さが高くなり、ΔHが大きく、ΔCp が大きくなっていることが分かります。一方で、HTは変性温度が最も高いものの、ΔHやΔCpはそれ程大きくないことが分かります。その結果、幅広い温度でΔGが正となり安定性が高くなっています。II+IIIのような変異体の変性温度はPA(野生型)よりも高くなっていますが、10℃付近でのΔGはPAの方が大きく野生型安定であると言えます。こうした研究結果は、変性温度がタンパク質の安定性をそのまま反映するわけでは無く、変性温度から離れた温度での安定性の評価にTmを用いる際には注意が必要であることを意味します。 6.2状態で変性するタンパク質の各温度における各状態の存在比ここでは、2状態で変性が進行するタンパク質の各状態の存在比率について、表1に記載の変性に伴う各熱力学的パラメータ、ΔH、ΔS、ΔCp、TG=0、ΔG298.15を用いて各温度でのΔG(図4)および各状態の存在比率(図6)について説明します。
ここではTmをTΔG=0と表記しました。
A, B, Cの3種類のタンパク質は変性温度が全て同一ですが、変性に伴う熱力学パラメータが異なるために25℃における天然状態と変性状態とのエネルギー差、ΔG298.15、が異なっています。特に、ΔCPが大きくなると温度の低下に伴うΔGの変化が大きいため、AとCは変性温度でのΔHとΔSが全く同じであるにもかかわらずΔCPが10kJK-1mol-1であるCのΔG298.15はAの値よりも小さくなっています。また、Dは変性温度がA~Cよりも20℃高くなっていますが、ΔHとΔSのバランスが異なるために、DのΔG298.15はAよりも小さくなっています。このように、熱変性に伴う熱力学量を正確に見積もれば、変性温度から離れた温度における安定性も評価できることとなります。 7.タンパク質の熱容量および天然状態と変性状態の熱容量差(ΔCP, ND)図3をみると天然状態のタンパク質の熱容量は温度に対して直線的に変化するように見えます。Privalovらの解析では変性状態の熱容量も温度に対して直線的に変化し、かつ、その勾配(dCP/dT)は天然状態と同じであるとみなして解析を行っていました。この場合、ΔCP, NDはどの温度でも一定となります。一方、Freireらは、変性状態のタンパク質やペプチドの熱容量はタンパク質を構成する各アミノ酸の熱容量の重量平均となることを報告しています。アミノ酸の熱容量は温度に対して直線的には変化せず3次関数となるこるため、変性状態のタンパク質の熱容量は3次関数となります。そのため、厳密には、ΔCP, NとΔCP, Dの差であるΔCP, NDは温度に対して一定にはならずに3次関数となるはずです。変性状態のタンパク質は会合傾向が強く、従って、実際の測定において熱容量を幅広い温度に渡って取得することは困難ですが、変性温度から離れた温度における安定性を評価する場合には上記の点に留意が必要です。 ΔCP, ND = 0.32(±0.04)ΔASAnp - 0.14(±0.04)ΔASApol (15) つまり、この式に従えば、変性に伴う極性表面の露出(ΔASApol)は熱容量の減少へ、非極性表面の露出(ΔASAnp)は熱容量の増加へ、と寄与することとなります。この関係式は多くのタンパク質の熱変性に対して当てはまりますが、変性温度付近における関係式であり、室温付近でタンパク質が低分子と相互作用する際の熱容量変化には当てはまらないケースがあることには注意が必要です。 8.熱統計力学に基づく熱容量曲線の非線形フィッティング(2状態および3状態変性)2状態変性を仮定してDSCにより観測された熱容量曲線を非線形フィッティングにより直接解析することで、変性に伴うΔHやTmなどを得られます。この場合、図3に示したような2状態変性だけでなく、中間状態を経て変性状態となる3状態変性の解析も可能です。こうした非線形フィッティングによるDSCデータの解析はFreireやKidokoroらによって研究が進められました。非線形フィッティングは市販の装置に付属のプログラムによってある程度は可能ですが、自作のプログラムによるシミュレーションを行いながら系内で進んでいる反応を解析する方が、結果の理解さらには解析に適した測定条件の探索が容易となります。本稿の著者はMathematicaを用いて解析式を記述し得られたデータの解析を行っています。 今後の予定9.会合体の熱変性の解析 用語説明タンパク質の“状態”とは?タンパク質溶液中において、タンパク質は機能を発揮する温度付近では天然状態をとっています。熱力学的な“状態”とはある一定の類似の構造を持ち類似の周囲環境を持つ集団を意味し、その集団の中で各分子は運動し周囲のイオンも結合や解離を繰り返しています。決して静的な特定の構造を持つ分子のみから構成されている系を意味するわけではありません。天然状態のタンパク質は、水素結合、イオン結合、分散力、疎水性相互作用などの寄与によりへリックスやシートが折りたたまった各タンパク質固有の立体構造を形成しています。温度の上昇に伴い分子内の運動性が上昇し、こういった結合が切断され、特定の三次元構造が崩壊し、変性状態へと移ります。変性状態の構造面からの定義は難しいですが、熱力学的には天然状態と同様に、ある一定の状態をとっている集団を意味します。 吸熱と発熱および熱力学量の符号ある系に熱が加わった時、つまり吸熱反応が起こった場合にはエンタルピーなどの熱力学量は正で表します。一方、系から熱が放出された場合、つまり発熱反応の場合には熱力学量は負で表します。 示差走査熱量計(Differential Scanning Calorimetry, DSC)と測定される物理量DSCによる測定の概要を説明します。DSCでは、断熱性が高い入れ物に収めた2つのセル(リファレンスセルとサンプルセル)の双方にヒーターを設置の上、2つのセルを含めた入れ物全体を一定速度で昇温させます。両セル間の温度差および入れ物とセルの間の温度差は熱電対などを用いてモニターします。入れ物と両セル間に温度差が無ければ、セルと外部との熱の出入りはありません。温度の上昇に伴い、両セル間に熱容量の差が生じると温度差が生じようとするが、温度差を検知したら素早く片方のセルのヒーターに電流を流しエネルギー補償を行うことでセル間には温度差が生じないように制御します。温度の上昇に伴いタンパク質が変性する際には、タンパク質溶液を入れたサンプルセル側の熱容量増加による吸熱が観測されるが、これは、タンパク質溶液中のタンパク質が変性する際にはエンタルピーが増えるために、温度差が生じないようにするためにはエンタルピーの増加に対応する分だけサンプルセル側に余分に電気エネルギーを投入する必要があることを意味します。 熱容量と比熱Cpは定圧熱容量とよばれます。DSCの測定で得た数値をモル濃度で割った値がモル熱容量であり、単位はJmol-1K-1です。重量濃度で割って1 gあたりの数値とした値が比熱であり、単位はJg-1K-1であらわします。ここで使われる“比”は“ 1 gあたり”を意味します。比熱以外にも比容、比重、などが使用されますが、重量あたりの数値であるので、得られた数値の検討の際に分子量の違いを考慮しなくても良いという特徴があります。 「相互作用解析の王道」について「相互作用解析の王道」は、2009年8月よりバイオダイレクトメールでお届けしています。
バイオダイレクトメールは弊社WEB会員向けメールマガジンです。バイオダイレクトメールの配信をご希望の方は、下記リンク先からご登録をお願いいたします。 関連リンク津本先生の研究内容や論文などはこちら→津本浩平先生の研究室Webサイト お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva