|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > BIA(生物物理学的相互作用解析) > 相互作用解析の王道 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
SPRを用いた分子間相互作用測定における、“低”固定化量の重要性Cytiva はじめに表面プラズモン共鳴(SPR)を検出原理とするアフィニティーセンサーは、分子間相互作用を軸とした生体分子の物性評価においてさまざまな情報を与えてくれます。また、測定装置の高感度化や固定化技術の進歩により、蛋白質‐蛋白質間相互作用のみならず、核酸、低分子化合物、ペプチド、など多様な生体分子の相互作用を解析することが可能となっています。ただし、実験条件によっては得られる結果が、本来の物性を反映しておらず、実験上のアーティファクトを多く含んでいる場合があることもわかってきています。では、なるべくアーティファクトを含まない結果を得るにはどうすればいいのでしょうか。
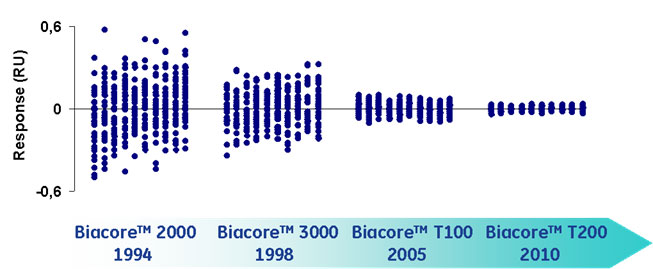
固定化量が多いことによる問題以前のBiacore™測定では、できるだけ固定化量を増やして、大きなレスポンスを検出するのが良いとされてきました。もちろん、固定化量を増やすとレスポンスが大きくなり、センサーグラムのS/Nは高くなります。しかし、Biacore™自体のS/Nが各段に向上した現在においては、固定化量を増やしてS/Nを上げる必要性はほとんどなくなりました(Fig.1)。逆に、固定化量を増やすことにより、センサーチップ表面上において起こる、分子クラウディング効果、凝集、マストランスポートなど、分子が高密度で存在するが故の測定上のアーティファクトが結果に含まれてしまいます。これらのアーティファクトは解析時に数学的に分離することは可能です。しかし、その分、計算時の変数が増え、本来求めるべき結合に伴う値の信頼性は低下します。すなわち、Biacore™測定においては、できるだけ固定化量を少なくし、アーティファクトがほとんど含まれないレスポンスを取得し、1:1結合モデルのような変数の少ないモデルを用いて、よりシンプルに結合レスポンスを解析することが理想の測定条件であると言えます。
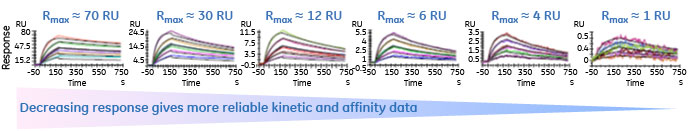
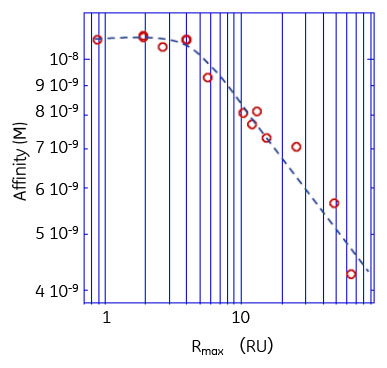
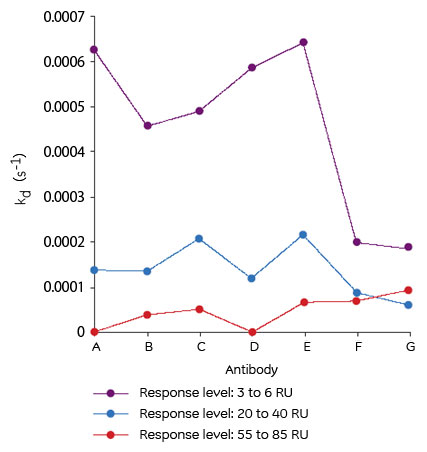
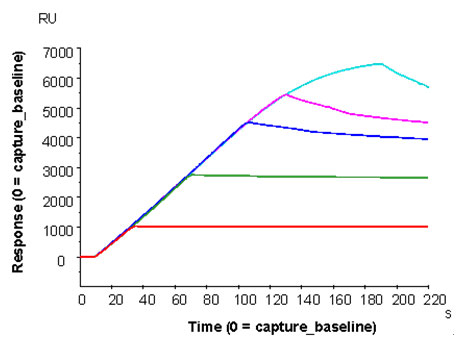
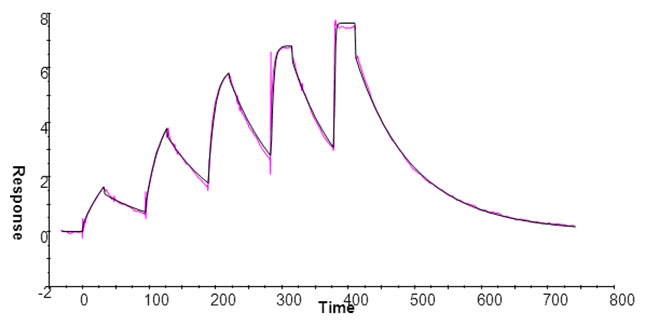
抗原抗体反応の検出におけるAvidity効果の回避Biacore™を用いて抗原抗体反応を検出する際、抗体をセンサーチップに固定化することで、Avidity効果を測定結果から排除し、1:1結合モデルで評価することが推奨されています。しかし、抗原側も抗体である場合や、抗原の消費量を減らしたい、抗原が膜タンパク質であるなどさまざまな要因で、抗体をアナライトとして使用する場合があります。その際には、抗原の固定化量を減らすことにより、Avidity効果を含まない結果を得ることができます。 Fig.2aに示したのは、IgEを抗原として固定化し、anti-IgE抗体をアナライトとしてBiacore™で測定したセンサーグラムです。また、IgEの固定化量を変えることによるRmaxの変化と、アフィニティーとの相関をプロットした結果をFig.2bに示しました。この場合のアフィニティーは1:1結合モデルを用いて算出されています。この結果を見ると、Rmaxの低下に伴い、算出されるアフィニティー(KD)は大きく(弱く)なっているのがわかります。また、Rmax=6以下の固定化量において、その変化が無くなっていることがわかります。この結果より、Rmax=6以下にすることにより、Avidity効果を含まないレスポンスを取得できることが示唆されました。このように、固定化量を減らすことにより、より正確にアフィニティーを算出できることがわかりました。 次に、解離速度定数(kd)の近い6種類の抗体の評価を、抗原の固定化量を変えて比較しました(Fig.3)。その結果、レスポンスレベルが3~6 RUとなるような固定化量で評価した場合に、明確に6種類の抗体のkd値をランキングすることができました。本結果は、固定化量を上げることにより、本来の解離速度よりも遅く算出されてしまう傾向にあること、及び、抗原の固定化量を減らすことにより、本来の解離速度が算出でき、非常に似通った解離のプロファイルを持つ抗体群を明確にランキングできることが示されました。 これらの結果から示されるように、抗原-抗体相互作用解析において、固定化量を減らし小さなレスポンスで評価することが、本来の物性を正確に求めるうえで非常に重要であることがわかります。
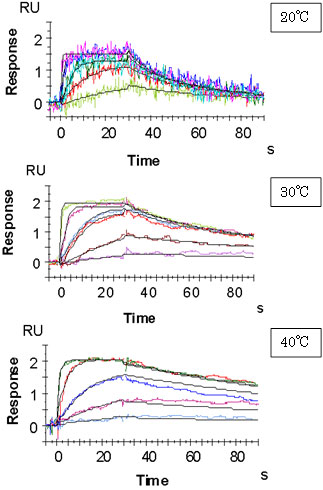
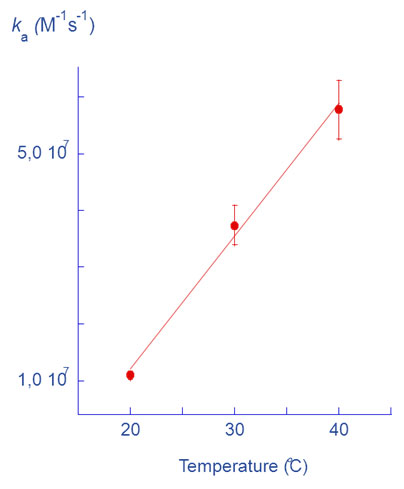
タンパク質-低分子相互作用測定における結合速度の評価これまでの分子間相互作用研究の成果により、最大結合レスポンス(Rmax)と、マストランスポート定数(kt)、解離速度定数(ka)には高い相関があり、低分子化合物のような非常に速い結合速度定数を示す相互作用を解析するには、以下の関係式に従い、Rmaxを小さくしてマストランスポートリミテーションを回避する必要があることがわかっています。 この相関式を実験的に証明するため、リガンドとしてThrombinを用い、アナライトとしてMelagatran(MW 429.5 Da)を用いて測定しました。最大レスポンスが3 RU以下になるように固定化量を設定し、測定温度を20℃、30℃、40℃と変化させて相互作用を測定しました(Fig.4a)。1:1結合モデルによりkaを算出し、測定温度に対してプロットした結果、温度の上昇に比例したkaの上昇が確認されました(Fig.4b)。これは、本測定条件において算出された結合速度定数は、マストランスポートリミテーションの影響をほとんど受けず、本来の物性を反映した値であることを示唆しています。本来、107 M-1s-1を超えるような結合速度定数をもつ相互作用は、平衡値解析を使う場合が多いのですが、今回のようにカイネティクス解析が可能であれば、アナライトを平衡値まで流す必要が無いため、アナライト濃度を落とすことができます。これにより、低溶解性化合物の測定が可能になり、また高濃度のアナライトで起こりやすい、非特異的な相互作用を回避できます。
安定的なリガンドのキャプチャー法Hisタグはタンパク質の精製、検出において最も広く用いられているtagの一つです。His-tagはNi2+を介してNTAとキレーティング反応により結合するため、精製だけではなく、固定化法としても非常に有用な方法です。しかし、これまでNTAチップを用いた固定化法は、キャプチャー後のリガンドの保持率が低く、ベースラインが大きくドリフトしてしまうため、特に低分子をアナライトにする場合においてはあまり使用されていませんでした。しかし、近年そのHis-tagタンパク質のキャプチャー量を低く抑えることにより、非常に安定的にNTAチップ上に保持できることがわかりました。
まとめ以前までのBiacore™の実験はできるだけ固定化して、高いレスポンスで結果を評価することが一般的でした。しかし、相互作用する分子の物性を正確に理解するには、固定化量を逆に減らし、高密度で分子が存在することによって生じるさまざまなリスクを実験的に回避することが非常に重要であることがわかってきました。現在、Biacore™ T200などの開発により、検出装置のS/Nは以前と比べ、各段に向上しています。よって、今後は検出感度の問題に縛られず、より小さなRmaxでの相互作用解析を進めることにより、今まで評価できなかった解離の遅いもの、結合の早いものの測定範囲は広がると考えられます。また、キャプチャー法を用いた低分子化合物の相互作用測定など、アッセイ系の構築の幅もより広がると考えられます。
「相互作用解析の王道」について「相互作用解析の王道」は、2009年8月よりバイオダイレクトメールでお届けしています。
バイオダイレクトメールは弊社WEB会員向けメールマガジンです。バイオダイレクトメールの配信をご希望の方は、下記リンク先からご登録をお願いいたします。 関連リンク津本先生の研究内容や論文などはこちら→津本浩平先生の研究室Webサイト お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva