|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > BIA(生物物理学的相互作用解析) > 相互作用解析の王道 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
実践編-4:フラグメントライブラリーの測定におけるSPR/ITC戦略の実効性と効率的活用法(2)目次
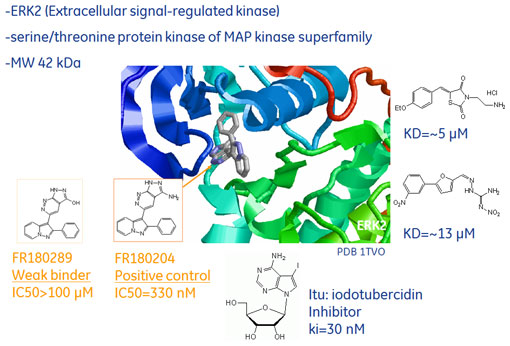
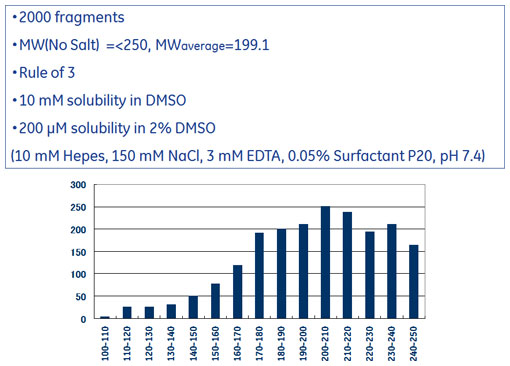
※本記事は「実践編-4:フラグメントライブラリーの測定におけるSPR/ITC戦略の実効性と効率的活用法(1)」の続きです。概略や手法についてはこちらをご覧ください。 ERK2を標的としたフラグメントスクリーニング実例(SPR)前回、フラグメント化合物の測定では、非特異的結合(NSB)を理解することが重要であることをご説明いたしました。このことから、異なる固定化方法を用いた2つのSPRスクリーニングを行い、それぞれの選出基準を重複して満たしたものが、NSBの影響による偽陽性を排除した"より確からしい"ヒット化合物になると予想しました。標的タンパク質としてMAPキナーゼの一種、ERK2を用い、フラグメントライブラリーとして東京大学創薬オープンイノベーションセンターから得た2000化合物を用いました(図1、2)。
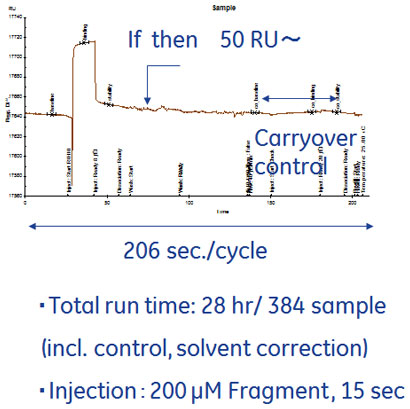
図3には実際のセンサーチップCM7を用いたスクリーニングでのセンサーグラムを示して測定条件をご説明しました。実はここでもNSBに対応したいくつかのテクニックを使っているのですが一つだけご紹介します。添加時間が15 secと短いところが特徴的に感じられるかもしれませんが、これはフラグメントの結合を観察するのに必要十分な長さであると同時に、余分なNSB成分をなるべくデータに含ませないようにするためのテクニックです。
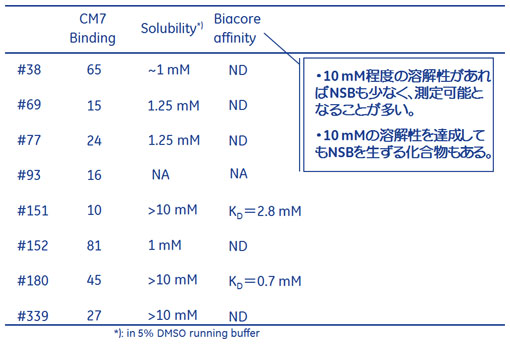
続いて、図4にはそれぞれの固定化法を用いたスクリーニングの選出基準をお示ししました。どちらも分子量200でKD=2mMの化合物を狙って設定していますが、固定化方法により特異的な結合レスポンスの大きさやNSBの起こりやすさが異なってくることは前回の表1でご紹介したとおりです。
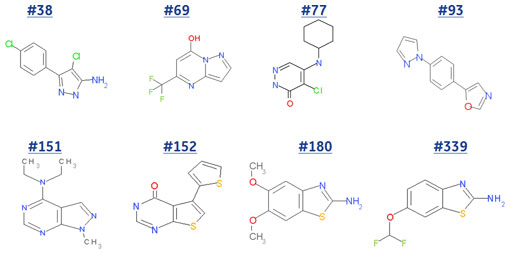
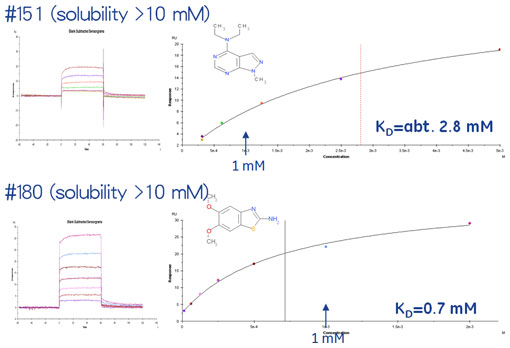
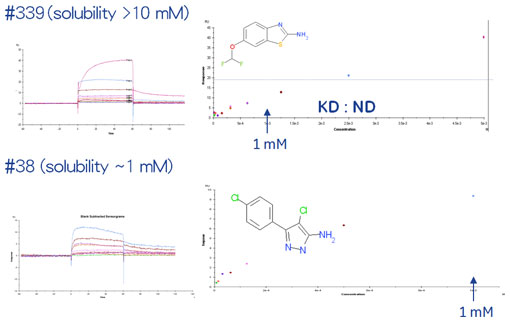
図5に最初の384化合物から選出された8化合物の構造、図6にSPRを用いたそれらのアフィニティー解析の結果をお示ししました。
ご覧のとおり#151や#181は溶解度も高く、KDが1 mMを超える弱い相互作用でさえも解析することが可能でした。ところが、#339は溶解度は高いものの、高濃度帯でNSBが観察され正確なKDを得ることはできませんでした。また、#38については溶解度も低く、解離の遅いNSBが観察されやはりKDを算出することはできませんでした。
このアフィニティー解析では、溶解度やNSBの問題で、すべての化合物に対してKD値を算出したりヒットバリデーションをしたりすることはしばしば困難になりますが、#38のような化合物でも特異的な結合をしている可能性は十分にあります。ここで結合の特異性を確認するために、ポジティブコントロールを用いたSPRの競合アッセイがしばしば行われますが、今回はITCを用い、特異的結合を確認するだけでなく、同時に発熱量ランキングを行うことを試みました。 次へ(ERK2を標的としたフラグメントスクリーニング実例(SPR)) 「相互作用解析の王道」について「相互作用解析の王道」は、2009年8月よりバイオダイレクトメールでお届けしています。
バイオダイレクトメールは弊社WEB会員向けメールマガジンです。バイオダイレクトメールの配信をご希望の方は、下記リンク先からご登録をお願いいたします。 関連リンク津本先生の研究内容や論文などはこちら→津本浩平先生の研究室Webサイト お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva